Cozaar 25mg, 50mg, 100mg Losartan Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je přípravek Cozaar 50 mg a jak se používá?
Cozaar je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze), snížení rizika mrtvice u některých lidí se srdečním onemocněním a diabetickou bolestí nervů (neuropatie). Cozaar 100 mg lze užívat samostatně nebo s jinými léky.
Cozaar 25 mg patří do třídy léků nazývaných antagonista receptoru angiotenzinu II (ARB).
Není známo, zda je přípravek Cozaar 25 mg bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Cozaar 100 mg?
Cozaar 100 mg může způsobit závažné nežádoucí účinky, včetně:
- točení hlavy,
- bolest nebo pálení při močení,
- nevolnost,
- slabost,
- štiplavý pocit,
- bolest na hrudi,
- nepravidelný srdeční tep,
- ztráta pohybů,
- malé nebo žádné močení,
- rychlý nárůst hmotnosti a
- otoky rukou, nohou nebo kotníků
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Cozaar patří:
- závrať,
- bolesti zad a
- příznaky nachlazení (ucpaný nos, kýchání, bolest v krku)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Cozaar. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
Po zjištění těhotenství přerušte co nejdříve léčbu přípravkem COZAAR. Léky, které působí přímo na renin-angiotensinový systém, mohou způsobit zranění a smrt vyvíjejícího se plodu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
POPIS
COZAAR (draselná sůl losartanu) je blokátor receptoru angiotenzinu II působící na podtyp receptoru AT1. Losartan draselný, nepeptidová molekula, je chemicky popsán jako monodraselná sůl 2-butyl-4-chlor-l-[p-(o-lH-tetrazol-5-ylfenyl)benzyl]imidazol-5-methanolu.
Jeho empirický vzorec je C22H22ClKN6O a jeho strukturní vzorec je:
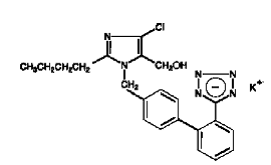
Losartan draselný je bílý až téměř bílý volně tekoucí krystalický prášek s molekulovou hmotností 461,01. Je volně rozpustný ve vodě, rozpustný v alkoholech a mírně rozpustný v běžných organických rozpouštědlech, jako je acetonitril a methylethylketon. Oxidací 5-hydroxymethylové skupiny na imidazolovém kruhu vzniká aktivní metabolit losartan.
COZAAR 100 mg je dostupný jako tablety pro perorální podání obsahující buď 25 mg, 50 mg nebo 100 mg draselné soli losartanu a následující neaktivní složky: mikrokrystalická celulóza, hydratovaná laktóza, předbobtnalý škrob, stearát hořečnatý, hydroxypropylcelulóza, hypromelóza a oxid titaničitý.
Tablety COZAAR 25 mg, 50 mg a 100 mg obsahují draslík v následujících množstvích: 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) a 8,48 mg (0,216 mEq). COZAAR 25 mg, COZAAR 50 mg a COZAAR 100 mg mohou také obsahovat karnaubský vosk.
INDIKACE
Hypertenze
COZAAR® je indikován k léčbě hypertenze u dospělých a dětských pacientů ve věku 6 let a starších, ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko fatálních a nefatálních kardiovaskulárních (KV) příhod, především mrtvice a infarktu myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd včetně losartanu.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než 1 lék. Konkrétní rady ohledně cílů a řízení naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak (National High Blood Pressure Education Program).
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu, a lze usuzovat, že se jedná o snížení krevního tlaku, a nikoli o některé další farmakologické vlastnosti drogy, což je z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika mrtvice, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je u populací podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů se očekává, že budou přínosem od agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie.
COZAAR lze podávat s jinými antihypertenzivy.
Hypertenzní pacienti s hypertrofií levé komory
COZAAR 25 mg je indikován ke snížení rizika cévní mozkové příhody u pacientů s hypertenzí a hypertrofií levé komory, ale existují důkazy, že tento přínos se nevztahuje na pacienty černé pleti [viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
Nefropatie u pacientů s diabetem 2. typu
COZAAR je indikován k léčbě diabetické nefropatie se zvýšeným sérovým kreatininem a proteinurií (poměr albuminu ke kreatininu v moči ≥ 300 mg/g) u hospitalizovaných pacientů s diabetem 2. typu a hypertenzí v anamnéze. V této populaci COZAAR 50 mg snižuje rychlost progrese nefropatie měřenou výskytem zdvojnásobení sérového kreatininu nebo terminálního onemocnění ledvin (potřeba dialýzy nebo transplantace ledvin) [viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Hypertenze
Hypertenze u dospělých
Obvyklá počáteční dávka přípravku COZAAR 50 mg je 50 mg jednou denně. Dávkování může být zvýšeno na maximální dávku 100 mg jednou denně podle potřeby ke kontrole krevního tlaku [viz Klinické studie ]. U pacientů s možnou intravaskulární deplecí (např. při léčbě diuretiky) se doporučuje počáteční dávka 25 mg.
Dětská hypertenze
Obvyklá doporučená počáteční dávka je 0,7 mg na kg jednou denně (až do 50 mg celkem) podávaná jako tableta nebo suspenze (viz Příprava suspenze (pro 200 ml 2,5 mg/ml suspenze) ] Dávkování by mělo být upraveno podle reakce krevního tlaku. Dávky nad 1,4 mg na kg (nebo vyšší než 100 mg) denně nebyly u pediatrických pacientů studovány (viz KLINICKÁ FARMAKOLOGIE , Klinické studie a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
COZAAR se nedoporučuje u pediatrických pacientů mladších 6 let nebo u pediatrických pacientů s odhadovanou rychlostí glomerulární filtrace nižší než 30 ml/min/1,73 m2 [viz Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE a Klinické studie ].
Hypertenzní pacienti s hypertrofií levé komory
Obvyklá počáteční dávka je 50 mg přípravku COZAAR jednou denně. Měl by být přidán hydrochlorothiazid 12,5 mg denně a/nebo dávka přípravku COZAAR by měla být zvýšena na 100 mg jednou denně s následným zvýšením hydrochlorothiazidu na 25 mg jednou denně na základě odpovědi krevního tlaku (viz Klinické studie ].
Nefropatie u pacientů s diabetem 2. typu
Obvyklá počáteční dávka je 50 mg jednou denně. Dávka by měla být zvýšena na 100 mg jednou denně na základě odpovědi krevního tlaku (viz Klinické studie ].
Úpravy dávkování u pacientů s poruchou funkce jater
U pacientů s mírnou až středně těžkou poruchou funkce jater je doporučená počáteční dávka přípravku COZAAR 25 mg jednou denně. COZAAR nebyl studován u pacientů s těžkou poruchou funkce jater (viz Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
Příprava suspenze (pro 200 ml 2,5 mg/ml suspenze)
Přidejte 10 ml purifikované vody USP do 8 uncové (240 ml) jantarové polyethylentereftalátové (PET) lahvičky obsahující deset 50 mg tablet COZAAR. Ihned protřepávejte alespoň 2 minuty. Koncentrát nechte 1 hodinu stát a poté 1 minutu protřepávejte, aby se obsah tablety dispergoval. Samostatně připravte objemovou směs 50/50 Ora-Plus™ a Ora-Sweet SF™. Přidejte 190 ml směsi 50/50 Ora-Plus™/Ora-Sweet SF™ k tabletě a vodní kaši v PET lahvi a protřepávejte po dobu 1 minuty, aby se složky dispergovaly. Suspenze by měla být chlazena při 2-8°C (36-46°F) a může být skladována po dobu až 4 týdnů. Před každým použitím suspenzi protřepejte a ihned vraťte do chladničky.
JAK DODÁVÁNO
Dávkové formy A Síly
- COZAAR 100 mg, 25 mg, jsou bílé, oválné, potahované tablety s kódem 951 na jedné straně.
- COZAAR, 50 mg, jsou bílé, oválné, potahované tablety s kódem 952 na jedné straně a půlicí rýhou na druhé straně.
- COZAAR 25 mg, 100 mg, jsou bílé potahované tablety ve tvaru slzy s kódem 960 na jedné straně.
Skladování A Manipulace
COZAAR je bílá potahovaná tableta dodávaná takto:
Skladujte při teplotě 25 °C (77 °F); povolené odchylky do 15-30°C (59-86°F) [viz USP Controlled Room Temperature]. Nádobu uchovávejte těsně uzavřenou. Chraňte před světlem.
Vyrobeno pro: Organon LLC, dceřiná společnost ORGANON & Co., Jersey City, NJ 07302, USA. Upraveno: říjen 2021.
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Hypertenze
Bezpečnost přípravku COZAAR byla hodnocena u více než 3 300 dospělých pacientů léčených pro esenciální hypertenzi a celkově u 4 058 pacientů/subjektů. Více než 1200 pacientů bylo léčeno déle než 6 měsíců a více než 800 více než jeden rok.
Léčba přípravkem COZAAR 25 mg byla dobře tolerována s celkovým výskytem nežádoucích účinků podobným jako u placeba. V kontrolovaných klinických studiích došlo k přerušení léčby pro nežádoucí účinky u 2,3 % pacientů léčených přípravkem COZAAR 25 mg au 3,7 % pacientů, kterým bylo podáváno placebo. Ve 4 klinických studiích zahrnujících více než 1 000 pacientů s různými dávkami (10–150 mg) draselného losartanu a více než 300 pacientů, kterým bylo podáváno placebo, se nežádoucí účinky, které se vyskytly u ≥ 2 % pacientů léčených přípravkem COZAAR 25 mg a častěji než placebo, objevily: závratě (3 % vs. 2 %), infekce horních cest dýchacích (8 % vs. 7 %), ucpaný nos (2 % vs. 1 %) a bolesti zad (2 % vs. 1 %).
Byly hlášeny následující méně časté nežádoucí účinky:
Poruchy krve a lymfatického systému: Anémie.
Psychiatrické poruchy: Deprese.
Poruchy nervového systému: Somnolence, bolest hlavy, poruchy spánku, parestézie, migréna.
Poruchy ucha a labyrintu: Vertigo, tinnitus.
Srdeční poruchy: Palpitace, synkopa, fibrilace síní, CMP.
Respirační, hrudní a mediastinální poruchy: Dušnost.
Gastrointestinální poruchy: Bolest břicha, zácpa, nevolnost, zvracení.
Poruchy kůže a podkoží: Kopřivka, pruritus, vyrážka, fotosenzitivita.
Poruchy svalové a kosterní soustavy a pojivové tkáně: Myalgie, artralgie.
Poruchy reprodukčního systému a prsou: Impotence.
Celkové poruchy a reakce v místě aplikace: Otok.
Kašel
Přetrvávající suchý kašel (s několikaprocentním výskytem) je spojován s užíváním ACE inhibitorů a v praxi může být příčinou přerušení léčby ACE inhibitory. Byly provedeny dvě prospektivní, dvojitě zaslepené, randomizované, kontrolované studie s paralelními skupinami, které měly zhodnotit účinky losartanu na výskyt hypertenzních pacientů s kašlem, kteří měli kašel při léčbě ACE inhibitory. Pacienti, kteří měli typický kašel s ACE-inhibitorem při stimulaci lisinoprilem, jejichž kašel po placebu vymizel, byli randomizováni k losartanu 50 mg, lisinoprilu 20 mg nebo buď placebu (jedna studie, n=97) nebo 25 mg hydrochlorothiazidu (n=135). Období dvojitě zaslepené léčby trvalo až 8 týdnů. Výskyt kašle je uveden v tabulce 1 níže.
Tyto studie ukazují, že výskyt kašle souvisejícího s terapií losartanem v populaci, jejíž všichni měli kašel spojený s terapií inhibitory ACE, je podobný jako výskyt spojený s terapií hydrochlorothiazidem nebo placebem.
Po uvedení losartanu na trh byly hlášeny případy kašle, včetně pozitivních opakovaných provokací.
Hypertenzní pacienti s hypertrofií levé komory
Ve studii Losartan Intervention for Endpoint (LIFE) byly nežádoucí účinky přípravku COZAAR 100 mg podobné těm, které byly dříve hlášeny u pacientů s hypertenzí.
Nefropatie u pacientů s diabetem 2. typu
Ve studii Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartan (RENAAL) study with 1513 patients treatment by COZAAR 100 mg orplacebo, the total incidences available nežádoucích účinků byla pro obě skupiny podobná. Přerušení léčby přípravkem COZAAR z důvodu vedlejších účinků bylo podobné jako u placeba (19 % u přípravku COZAAR 100 mg, 24 % u placeba). Nežádoucí účinky, bez ohledu na lékový vztah, hlášené s incidencí ≥ 4 % pacientů léčených přípravkem COZAAR 50 mg a vyskytující se s ≥ 2 % rozdílem ve skupině s losartanem oproti placebu na pozadí konvenční antihypertenzní léčby, byly astenie/únava, bolest na hrudi hypotenze, ortostatická hypotenze, průjem, anémie, hyperkalémie, hypoglykémie, bolesti zad, svalová slabost a infekce močových cest.
Postmarketingové zkušenosti
Následující další nežádoucí účinky byly hlášeny po uvedení přípravku COZAAR na trh. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku:
Zažívací: Hepatitida.
Obecné poruchy a podmínky v místě podání: Nevolnost.
Hematologické: Trombocytopenie.
Přecitlivělost: U pacientů léčených losartanem byl vzácně hlášen angioedém, včetně otoku hrtanu a hlasivkové štěrbiny, způsobující obstrukci dýchacích cest a/nebo otok obličeje, rtů, hltanu a/nebo jazyka; někteří z těchto pacientů dříve prodělali angioedém s jinými léky včetně ACE inhibitorů. Byla hlášena vaskulitida, včetně Henoch-Schönleinovy purpury. Byly hlášeny anafylaktické reakce.
Metabolismus a výživa: Hyponatrémie.
Muskuloskeletální: Rabdomyolýza.
Poruchy nervového systému: Dysgeuzie.
Kůže: Erytrodermie.
DROGOVÉ INTERAKCE
Činidla zvyšující sérový draslík
Současné podávání losartanu s jinými léky, které zvyšují hladiny draslíku v séru, může vést k hyperkalémii. U těchto pacientů monitorujte hladinu draslíku v séru.
Lithium
Při současném podávání lithia s antagonisty receptoru angiotensinu II bylo hlášeno zvýšení sérových koncentrací lithia a toxicita lithia. Při současném užívání sledujte hladiny lithia v séru.
Nesteroidní protizánětlivé léky (NSAID) včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2)
U pacientů, kteří jsou starší, s deplecí objemu (včetně těch, kteří jsou léčeni diuretiky) nebo mají sníženou funkci ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s antagonisty receptoru angiotenzinu II (včetně losartanu) vést ke zhoršení funkce ledvin, včetně možného akutního renálního selhání. Tyto účinky jsou obvykle reverzibilní. U pacientů léčených losartanem a NSAID pravidelně monitorujte renální funkce.
Antihypertenzní účinek antagonistů receptoru angiotenzinu II, včetně losartanu, může být zeslaben NSAID, včetně selektivních inhibitorů COX-2.
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, synkopy, hyperkalemie a změn renálních funkcí (včetně akutního renálního selhání) ve srovnání s monoterapií.
Do studie Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) bylo zařazeno 1448 pacientů s diabetem 2. typu, zvýšeným poměrem albuminu a kreatininu v moči a sníženou odhadovanou rychlostí glomerulární filtrace (GFR 30 až 89,9 ml/min), randomizováni k léčbě lisinoprilem. nebo placebo na pozadí léčby losartanem a sledovali je po dobu mediánu 2,2 roku. Pacienti, kteří dostávali kombinaci losartanu a lisinoprilu, nezískali žádný další přínos ve srovnání s monoterapií pro kombinovaný cílový ukazatel poklesu GFR, konečného stádia onemocnění ledvin nebo úmrtí, ale zaznamenali zvýšený výskyt hyperkalemie a akutního poškození ledvin ve srovnání se skupinou s monoterapií.
většiny pacientů nebyl spojen žádný přínos se současným užíváním dvou inhibitorů RAS. Obecně se vyhněte kombinovanému užívání inhibitorů RAS. Pečlivě sledujte krevní tlak, funkci ledvin a elektrolyty u pacientů užívajících přípravek COZAAR 100 mg a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s přípravkem COZAAR 100 mg pacientům s diabetem. Vyhněte se použití aliskirenu s přípravkem COZAAR u pacientů s poruchou funkce ledvin (GFR
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Fetální toxicita
COZAAR může způsobit poškození plodu, když je podáván těhotné ženě. Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Když je zjištěno těhotenství, přerušte COZAAR 100 mg co nejdříve [viz Použití u konkrétních populací ].
Hypotenze u pacientů se sníženým objemem nebo solí
U pacientů s aktivovaným systémem renin-angiotenzin, jako jsou pacienti s deplecí objemu nebo solí (např. pacienti léčení vysokými dávkami diuretik), se po zahájení léčby přípravkem COZAAR může objevit symptomatická hypotenze. Upravte depleci objemu nebo soli před podáním přípravku COZAAR (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Zhoršení funkce ledvin
Změny renálních funkcí včetně akutního renálního selhání mohou být způsobeny léky, které inhibují renin-angiotensinový systém a diuretiky. Pacienti, jejichž funkce ledvin může částečně záviset na aktivitě renin-angiotenzinového systému (např. pacienti se stenózou renální arterie, chronickým onemocněním ledvin, těžkým městnavým srdečním selháním nebo deplecí objemu), mohou být vystaveni zvláštnímu riziku rozvoje akutního selhání ledvin při léčbě přípravkem COZAAR. U těchto pacientů pravidelně sledujte renální funkce. Zvažte pozastavení nebo přerušení léčby u pacientů, u kterých dojde ke klinicky významnému snížení renálních funkcí na COZAAR (viz DROGOVÉ INTERAKCE a Použití u konkrétních populací ].
Hyperkalémie
Pravidelně sledujte hladinu draslíku v séru a vhodně léčte. Může být nutné snížit dávku nebo vysadit přípravek COZAAR 25 mg (viz NEŽÁDOUCÍ REAKCE ].
Současné užívání jiných léků, které mohou zvýšit hladinu draslíku v séru, může vést k hyperkalémii (viz DROGOVÉ INTERAKCE ].
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA (Informace pro pacienta).
Těhotenství
Informujte pacientky ve fertilním věku o důsledcích expozice přípravku COZAAR 100 mg během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Řekněte pacientkám, aby co nejdříve hlásili těhotenství svým lékařům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Draslíkové doplňky
Poraďte pacientům užívajícím přípravek COZAAR, aby nepoužívali doplňky draslíku nebo náhražky soli obsahující draslík bez konzultace se svým poskytovatelem zdravotní péče [viz DROGOVÉ INTERAKCE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Losartan draselný nebyl karcinogenní, když byl podáván v maximálních tolerovaných dávkách potkanům a myším po dobu 105 a 92 týdnů. Samice potkanů, kterým byla podávána nejvyšší dávka (270 mg/kg/den), měly mírně vyšší výskyt pankreatického acinárního adenomu. Maximální tolerované dávky (270 mg/kg/den u potkanů, 200 mg/kg/den u myší) poskytly systémové expozice losartanu a jeho farmakologicky aktivního metabolitu, které byly přibližně 160krát a 90krát (krysy) a 30krát a 15krát (myši). expozice člověka vážícího 50 kg při podání 100 mg denně.
Losartan draselný byl negativní v testech mikrobiální mutageneze a mutageneze savčích buněk V-79 a v testech in vitro alkalické eluce a in vitro a in vivo testech chromozomálních aberací. Kromě toho aktivní metabolit nevykazoval žádné známky genotoxicity v testech mikrobiální mutageneze, in vitro alkalické eluce a in vitro testů chromozomálních aberací.
Fertilita a reprodukční schopnost nebyly ovlivněny ve studiích se samci potkanů, kterým byly perorálně podávány dávky draselného losartanu až do přibližně 150 mg/kg/den. Podání toxických dávek u žen (300/200 mg/kg/den) bylo spojeno s významným (p
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
COZAAR může způsobit poškození plodu, když je podáván těhotné ženě. Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenznímu užívání v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv. Po zjištění těhotenství přerušte co nejdříve léčbu přípravkem COZAAR (viz Klinické úvahy ).
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Hypertenze v těhotenství zvyšuje u matky riziko preeklampsie, gestačního diabetu, předčasného porodu a porodních komplikací (např. nutnost císařského řezu, poporodní krvácení). Hypertenze zvyšuje riziko fetálního omezení intrauterinního růstu a intrauterinní smrti. Těhotné ženy s hypertenzí by měly být pečlivě sledovány a odpovídajícím způsobem léčeny.
Fetální/neonatální nežádoucí reakce

Oligohydramnion u těhotných žen, které užívají léky ovlivňující renin-angiotensinový systém ve druhém a třetím trimestru těhotenství, může mít za následek následující: sníženou funkci ledvin plodu vedoucí k anurii a selhání ledvin, hypoplazii plic plodu, deformace skeletu, včetně hypoplazie lebky, hypotenzi a smrt. V neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativa k léčbě léky ovlivňujícími renin-angiotensinový systém, informujte matku o potenciálním riziku pro plod.
pacientek užívajících COZAAR během těhotenství proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. V závislosti na týdnu těhotenství může být vhodné fetální testování. Pokud je pozorován oligohydramnion, přerušte léčbu přípravkem COZAAR 50 mg, pokud to není považováno za záchranu života matky. Pacienti a lékaři by si však měli být vědomi toho, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění.
Pečlivě sledujte novorozence s anamnézou expozice COZAAR in utero kvůli hypotenzi, oligurii a hyperkalemii. U novorozenců s anamnézou in utero expozice přípravku COZAAR 100 mg, pokud se objeví oligurie nebo hypotenze, podpořte krevní tlak a renální perfuzi. Výměnné transfuze nebo dialýza mohou být vyžadovány jako prostředek zvrácení hypotenze a nahrazení funkce ledvin.
Data
Údaje o zvířatech
Losartan draselný byl podáván orálně krysám během období pozdní březosti až laktace (15. den gestace až 20. den laktace) v dávkách 10, 25 a 100 mg/kg/den. Bylo prokázáno, že draselná sůl losartanu vyvolává nežádoucí účinky u plodů potkanů a novorozenců, včetně snížení tělesné hmotnosti, opožděného fyzického a behaviorálního vývoje, mortality a renální toxicity. S výjimkou novorozeneckého přírůstku hmotnosti (který byl ovlivněn již při dávkách 10 mg/kg/den), dávky spojené s těmito účinky přesáhly 25 mg/kg/den (přibližně trojnásobek maximální doporučené dávky pro člověka 100 mg na mg /m základ). Tyto nálezy jsou připisovány expozici léku v pozdní gestaci a během laktace. Bylo prokázáno, že významné hladiny losartanu a jeho aktivního metabolitu jsou přítomny v potkaní fetální plazmě během pozdní gestace a v mléce potkanů.
Laktace
Shrnutí rizik
Není známo, zda je losartan vylučován do mateřského mléka, ale v mléce potkanů byly prokázány významné hladiny losartanu a jeho aktivního metabolitu. Vzhledem k potenciálu nežádoucích účinků na kojené dítě je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu význam léku pro matku.
Pediatrické použití
Antihypertenzní účinky přípravku COZAAR byly stanoveny u hypertenzních pediatrických pacientů ve věku 6 až 16 let. Bezpečnost a účinnost nebyla stanovena u pediatrických pacientů mladších 6 let nebo u pediatrických pacientů s rychlostí glomerulární filtrace DÁVKOVÁNÍ A PODÁVÁNÍ , KLINICKÁ FARMAKOLOGIE a Klinické studie ].
Geriatrické použití
celkového počtu pacientů užívajících COZAAR 25 mg v kontrolovaných klinických studiích hypertenze bylo 391 pacientů (19 %) ve věku 65 let a více, zatímco 37 pacientů (2 %) bylo ve věku 75 let a více. V kontrolované klinické studii ochrany ledvin u pacientů s diabetem 2. typu s proteinurií bylo 248 pacientů (33 %) ve věku 65 let a více. V kontrolované klinické studii na snížení kombinovaného rizika kardiovaskulární smrti, cévní mozkové příhody a infarktu myokardu u hypertoniků s hypertrofií levé komory bylo 2 857 pacientů (62 %) ve věku 65 let a více, zatímco 808 pacientů (18 %) bylo ve věku 75 let a více . Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti, nelze však vyloučit větší citlivost některých starších jedinců.
Závod
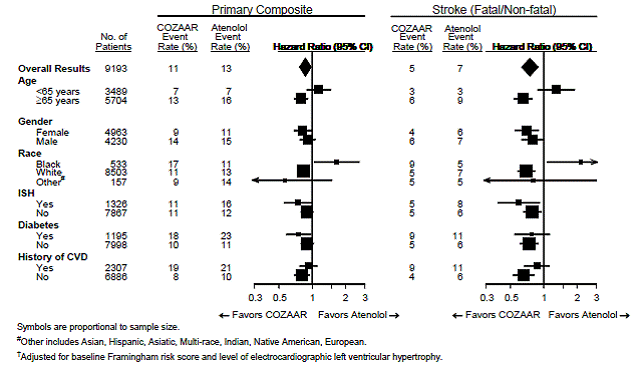
Ve studii LIFE měli černošští pacienti s hypertenzí a hypertrofií levé komory léčení atenololem nižší riziko výskytu primárního složeného cílového parametru ve srovnání s černošskými pacienty léčenými přípravkem COZAAR (oba souběžně léčeni hydrochlorothiazidem u většiny pacientů). Primárním cílovým parametrem byl první výskyt cévní mozkové příhody, infarktu myokardu nebo kardiovaskulárního úmrtí, analyzovaný za použití přístupu intence-to-treat (ITT). V podskupině černošských pacientů (n=533, 6 % pacientů ze studie LIFE) bylo 29 primárních cílových ukazatelů mezi 263 pacienty na atenololu (11 %, 26 na 1000 pacientoroků) a 46 primárních cílových ukazatelů mezi 270 pacienty (17 % , 42 na 1000 pacientoroků) na COZAAR. Toto zjištění nemohlo být vysvětleno na základě rozdílů v populacích jiných než rasa nebo na jakékoli nevyváženosti mezi léčebnými skupinami. Navíc snížení krevního tlaku v obou léčebných skupinách bylo konzistentní u černošských a nečerných pacientů. Vzhledem k obtížnosti interpretace rozdílů podskupin ve velkých studiích nelze vědět, zda je pozorovaný rozdíl výsledkem náhody. Studie LIFE však neposkytuje žádné důkazy o tom, že přínosy COZAAR 100 mg na snížení rizika kardiovaskulárních příhod u hypertenzních pacientů s hypertrofií levé komory se vztahují na černošské pacienty [viz Klinické studie ].
Renální poškození
Pacienti s renální insuficiencí mají zvýšené plazmatické koncentrace losartanu a jeho aktivního metabolitu ve srovnání s jedinci s normální funkcí ledvin. U pacientů s poruchou funkce ledvin není nutná žádná úprava dávky, pokud pacient s poruchou funkce ledvin nemá také objemovou depleci (viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Doporučená počáteční dávka přípravku COZAAR je 25 mg u pacientů s mírnou až středně těžkou poruchou funkce jater. Po perorálním podání pacientům s mírnou až středně těžkou poruchou funkce jater byly plazmatické koncentrace losartanu a jeho aktivního metabolitu 5krát a 1,7krát vyšší než u zdravých dobrovolníků. COZAAR nebyl studován u pacientů s těžkou poruchou funkce jater (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Významná letalita byla pozorována u myší a potkanů po perorálním podání 1000 mg/kg a 2000 mg/kg, v daném pořadí, což je asi 44 a 170násobek maximální doporučené dávky pro člověka na základě mg/m2.
předávkování u lidí jsou k dispozici omezené údaje. Nejpravděpodobnějším projevem předávkování by byla hypotenze a tachykardie; bradykardie se může objevit z parasympatické (vagální) stimulace. Pokud dojde k symptomatické hypotenzi, je třeba zahájit podpůrnou léčbu.
Losartan ani jeho aktivní metabolit nelze odstranit hemodialýzou.
KONTRAINDIKACE
COZAAR 50 mg je kontraindikován:
- U pacientů, kteří jsou přecitlivělí na kteroukoli složku tohoto přípravku.
- Ke společnému podávání s aliskirenem u pacientů s diabetem.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Angiotenzin II [vzniká z angiotenzinu I reakcí katalyzovanou angiotensin konvertujícím enzymem (ACE, kinináza II)] je silný vazokonstriktor, primární vazoaktivní hormon systému renin-angiotenzin a důležitá složka v patofyziologii hypertenze. Stimuluje také sekreci aldosteronu kůrou nadledvin. Losartan a jeho hlavní aktivní metabolit blokují vazokonstrikční a aldosteron vylučující účinky angiotensinu II selektivním blokováním vazby angiotenzinu II na AT1 receptor, který se nachází v mnoha tkáních (např. hladké svalstvo cév, nadledvinka). V mnoha tkáních se také nachází receptor AT1, ale není známo, že by byl spojen s kardiovaskulární homeostázou. Ani losartan, ani jeho hlavní aktivní metabolit nevykazují žádnou částečnou agonistickou aktivitu na receptoru AT1 a oba mají mnohem větší afinitu (asi 1000krát) k receptoru AT1 než k receptoru AT1. Vazebné studie in vitro ukazují, že losartan je reverzibilní, kompetitivní inhibitor receptoru AT1. Aktivní metabolit je hmotnostně 10 až 40krát účinnější než losartan a zdá se, že jde o reverzibilní, nekompetitivní inhibitor receptoru AT1.
Losartan ani jeho aktivní metabolit neinhibují ACE (kininázu II, enzym, který přeměňuje angiotensin I na angiotenzin II a odbourává bradykinin), ani se nevážou ani neblokují jiné hormonální receptory nebo iontové kanály, o nichž je známo, že jsou důležité v kardiovaskulární regulaci.
Farmakodynamika
Losartan inhibuje presorický účinek infuzí angiotensinu II (stejně jako angiotenzinu I). Dávka 100 mg inhibuje presorický účinek asi o 85 % na vrcholu, přičemž 25-40 % inhibice přetrvává po dobu 24 hodin. Odstranění negativní zpětné vazby angiotenzinu II způsobuje zdvojnásobení až ztrojnásobení plazmatické aktivity reninu a následné zvýšení plazmatické koncentrace angiotenzinu II u hypertoniků. Losartan neovlivňuje odpověď na bradykinin, zatímco inhibitory ACE zvyšují odpověď na bradykinin. Plazmatické koncentrace aldosteronu po podání losartanu klesají. Navzdory účinku losartanu na sekreci aldosteronu byl pozorován velmi malý účinek na hladinu draslíku v séru.
Účinek losartanu je v podstatě přítomen během jednoho týdne, ale v některých studiích se maximální účinek objevil za 3-6 týdnů. V dlouhodobých následných studiích (bez kontroly placebem) se zdálo, že účinek losartanu přetrvává až po dobu jednoho roku. Po náhlém vysazení losartanu není patrný žádný rebound fenomén. V kontrolovaných studiích nedošlo v podstatě k žádné změně průměrné srdeční frekvence u pacientů léčených losartanem.
Farmakokinetika
Vstřebávání
Po perorálním podání se losartan dobře vstřebává a podléhá podstatnému metabolismu prvního průchodu játry. Systémová biologická dostupnost losartanu je přibližně 33 %. Průměrné maximální koncentrace losartanu a jeho aktivního metabolitu jsou dosaženy za 1 hodinu, respektive za 3-4 hodiny. Zatímco maximální plazmatické koncentrace losartanu a jeho aktivního metabolitu jsou přibližně stejné, AUC (plocha pod křivkou) metabolitu je asi 4krát větší než u oflosartanu. Jídlo zpomaluje absorpci losartanu a snižuje jeho Cmax, ale má pouze malý vliv na AUC losartanu nebo na AUC metabolitu (~10% snížení). Farmakokinetika losartanu a jeho aktivního metabolitu je lineární s perorálními dávkami losartanu až do 200 mg a v průběhu času se nemění.
Rozdělení
Distribuční objem losartanu a aktivního metabolitu je asi 34 litrů, respektive 12 litrů. Losartan i jeho aktivní metabolit se vysoce váží na plazmatické proteiny, především albumin, s plazmatickými volnými frakcemi 1,3 % a 0,2 %. Vazba na plazmatické proteiny je konstantní v celém koncentračním rozsahu dosaženém doporučenými dávkami. Studie na potkanech ukazují, že losartan prochází hematoencefalickou bariérou špatně, pokud vůbec.
Metabolismus
Losartan je perorálně účinná látka, která podléhá podstatnému metabolismu prvního průchodu enzymy cytochromu P450. Částečně se přeměňuje na aktivní metabolit karboxylové kyseliny, který je odpovědný za většinu antagonismu receptoru angiotensinu II, který následuje po léčbě losartanem. Asi 14 % perorálně podané dávky losartanu se přemění na aktivní metabolit. Kromě aktivního metabolitu karboxylové kyseliny se tvoří několik neaktivních metabolitů. Studie in vitro ukazují, že cytochrom P450 2C9 a 3A4 se účastní biotransformace losartanu na jeho metabolity.
Odstranění
Celková plazmatická clearance losartanu a aktivního metabolitu je přibližně 600 ml/min, respektive 50 ml/min, s renální clearance přibližně 75 ml/min a 25 ml/min. Terminální poločas losartanu je asi 2 hodiny a metabolitu asi 6-9 hodin. Po jednotlivých dávkách losartanu podaných perorálně se asi 4 % dávky vyloučí v nezměněné podobě močí a asi 6 % se vyloučí močí jako aktivní metabolit. Vylučování žlučí přispívá k eliminaci oflosartanu a jeho metabolitů. Po perorálním podání losartanu značeného 14C se asi 35 % radioaktivity objeví v moči a asi 60 % ve stolici. Po intravenózní dávce 14C-značeného losartanu se asi 45 % radioaktivity objeví v moči a 50 % ve stolici. Losartan ani jeho metabolit se při opakovaném podávání jednou denně nehromadí v plazmě.
Specifické populace
Pediatrická
Farmakokinetické parametry po opakovaných dávkách losartanu (průměrná dávka 0,7 mg/kg, rozmezí 0,36 až 0,97 mg/kg) ve formě tablety 25 pacientům s hypertenzí ve věku 6 až 16 let jsou uvedeny v tabulce 4 níže. Farmakokinetika losartanu a jeho aktivního metabolitu byla obecně podobná napříč studovanými věkovými skupinami a podobná historickým farmakokinetickým údajům u dospělých. Základní farmakokinetické parametry u dospělých a dětí jsou uvedeny v tabulce níže.
Biologická dostupnost suspenzní formulace byla porovnána s tabletami losartanu u zdravých dospělých. Suspenze a tableta mají podobnou biologickou dostupnost jak s losartanem, tak s aktivním metabolitem (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Geriatrické a genderové
Farmakokinetika losartanu byla zkoumána u starších osob (65-75 let) au obou pohlaví. Plazmatické koncentrace losartanu a jeho aktivního metabolitu jsou u starších a mladých hypertoniků podobné. Plazmatické koncentrace losartanu byly u žen s hypertenzí asi dvakrát vyšší než u hypertoniků mužů, ale koncentrace aktivního metabolitu byly u mužů a žen podobné. Není nutná žádná úprava dávkování [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Závod
Farmakokinetické rozdíly způsobené rasou nebyly studovány [viz Použití u konkrétních populací ].
Renální insuficience
Po perorálním podání jsou plazmatické koncentrace a AUC losartanu a jeho aktivního metabolitu zvýšeny o 50-90 % u pacientů s mírnou (clearance kreatininu 50 až 74 ml/min) nebo středně těžkou (clearance kreatininu 30 až 49 ml/min) renální insuficiencí . V této studii byla renální clearance snížena o 55-85 % jak pro losartan, tak pro jeho aktivní metabolit u pacientů s mírnou nebo středně těžkou renální insuficiencí. Ani losartan, ani jeho aktivní metabolit nelze odstranit hemodialýzou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Jaterní nedostatečnost
Po perorálním podání pacientům s mírnou až středně těžkou alkoholickou cirhózou jater byly plazmatické koncentrace losartanu a jeho aktivního metabolitu 5krát vyšší, respektive přibližně 1,7krát vyšší než u mladých dobrovolníků mužského pohlaví. Ve srovnání s normálními jedinci byla celková plazmatická clearance losartanu hospitalizovaných s jaterní insuficiencí asi o 50 % nižší a perorální biologická dostupnost byla asi dvojnásobná. U pacientů s mírnou až středně těžkou poruchou funkce jater použijte počáteční dávku 25 mg. COZAAR 50 mg nebyl studován u pacientů s těžkou poruchou funkce jater (viz DÁVKOVÁNÍ A PODÁVÁNÍ a Použití u konkrétních populací ].
Lékové interakce
Ve studiích draselné soli losartanu s hydrochlorothiazidem, digoxinem, warfarinem, cimetidinem a fenobarbitalem nebyly zjištěny žádné klinicky významné lékové interakce. Bylo však prokázáno, že rifampin snižuje AUC losartanu a jeho aktivního metabolitu o 30 % a 40 %. Flukonazol, inhibitor cytochromu P450 2C9, snížil AUC aktivního metabolitu přibližně o 40 %, ale zvýšil AUC losartanu přibližně o 70 % po opakovaných dávkách. Konverze losartanu na jeho aktivní metabolit po intravenózním podání není ketokonazolem ovlivněna, inhibitor P450 3A4. AUC aktivního metabolitu po perorálním losartanu nebyla ovlivněna erytromycinem, inhibitorem P450 3A4, ale AUC losartanu byla zvýšena o 30 %.
Farmakodynamické důsledky současného užívání losartanu a inhibitorů P450 2C9 nebyly zkoumány. U jedinců, kteří nemetabolizují losartan na aktivní metabolit, bylo prokázáno, že mají specifický, vzácný defekt v cytochromu P450 2C9. Tyto údaje naznačují, že přeměna losartanu na jeho aktivní metabolit je zprostředkována primárně P450 2C9 a nikoli P450 3A4.
Klinické studie
Hypertenze
Hypertenze u dospělých
Antihypertenzní účinky přípravku COZAAR 25 mg byly prokázány především ve 4 placebem kontrolovaných 6- až 12týdenních studiích s dávkami od 10 do 150 mg denně u pacientů s výchozím diastolickým krevním tlakem 95-115. Studie umožnily srovnání dvou dávek (50-100 mg/den) jako režimy jednou denně nebo dvakrát denně, srovnání maximálních a nejnižších účinků a srovnání odpovědi podle pohlaví, věku a rasy. Tři další studie zkoumaly antihypertenzní účinky losartanu a hydrochlorothiazidu v kombinaci.
studie monoterapie losartanem zahrnovaly celkem 1075 pacientů randomizovaných do několika dávek losartanu a 334 do skupiny s placebem. Dávky 10 a 25 mg vyvolaly určitý účinek na vrcholu (6 hodin po podání), ale malé a nekonzistentní nejnižší (24 hodin) odpovědi. Dávky 50, 100 a 150 mg jednou denně vedly ke statisticky významnému systolickému/diastolickému průměrnému snížení krevního tlaku ve srovnání s placebem v rozmezí 5,5-10,5/3,5-7,5 mmHg, přičemž dávka 150 mg neměla větší účinek než 50- 100 mg. Dávkování 50-100 mg/den dvakrát denně poskytlo konzistentně větší minimální odezvy než dávkování jednou denně při stejné celkové dávce. Vrchol (6 hodin) účinky byly rovnoměrně, ale středně, větší než minimální účinky, s poměrem mezi minimem a vrcholem pro systolické a diastolické odpovědi 50–95 % a 60–90 %.
Přidání nízké dávky hydrochlorothiazidu (12,5 mg) k losartanu 50 mg jednou denně vedlo k placebu upravenému snížení krevního tlaku o 15,5/9,2 mmHg.
Analýza věkových, pohlaví a rasových podskupin pacientů ukázala, že muži a ženy a pacienti starší a mladší 65 let měli obecně podobné odpovědi. COZAAR 25 mg byl účinný při snižování krevního tlaku bez ohledu na rasu, i když u černošských pacientů (obvykle populace s nízkým obsahem reninu) byl účinek poněkud menší.
Dětská hypertenze
Antihypertenzní účinek losartanu byl studován v jedné studii zahrnující 177 hypertenzních pediatrických pacientů ve věku 6 až 16 let. Děti s hmotností DÁVKOVÁNÍ A PODÁVÁNÍ ]. Většina dětí měla hypertenzi spojenou s renálním a urogenitálním onemocněním. Diastolický krevní tlak vsedě (SiDBP) při vstupu do studie byl vyšší než 95. percentil pro věk, pohlaví a výšku pacienta. Na konci tří týdnů losartan snižoval systolický a diastolický krevní tlak, měřeno v době minima, v závislosti na dávce. Celkově dvě vyšší dávky (25 až 50 mg u pacientů 50 kg). Zdá se, že nejnižší dávka, odpovídající průměrné denní dávce 0,07 mg/kg, nenabízí konzistentní antihypertenzní účinnost. Když byli pacienti randomizováni k pokračování losartanu ve dvou vyšších dávkách nebo k placebu po 3 týdnech léčby, zvýšil se minimální diastolický krevní tlak u pacientů na placebu o 5 až 7 mmHg více než u pacientů randomizovaných k pokračování losartanu. Když byla nízká dávka losartanu náhodně vysazena, vzestup minimálního diastolického krevního tlaku byl stejný u pacientů užívajících placebo au těch, kteří pokračovali v léčbě losartanem, což opět naznačuje, že nejnižší dávka neměla významný antihypertenzní účinek. Celkově nebyly zjištěny žádné signifikantní rozdíly v celkovém antihypertenzním účinku losartanu, když byli pacienti analyzováni podle věku (
Hypertenzní pacienti s hypertrofií levé komory
Studie LIFE byla nadnárodní, dvojitě zaslepená studie srovnávající přípravek COZAAR 50 mg a atenolol u 9 193 hypertoniků s EKG dokumentovanou hypertrofií levé komory. Pacienti s infarktem myokardu nebo cévní mozkovou příhodou během šesti měsíců před randomizací byli vyloučeni. Pacienti byli randomizováni tak, aby dostávali jednou denně COZAAR 50 mg nebo atenolol 50 mg. Pokud nebylo dosaženo cílového krevního tlaku (
randomizovaných pacientů bylo 4963 (54 %) žen a 533 (6 %) černochů. Průměrný věk byl 67 s 5 704 (62 %) věkem ≥ 65. Na začátku mělo 1195 (13 %) diabetes, 1326 (14 %) izolovanou systolickou hypertenzi, 1469 (16 %) koronární srdeční onemocnění a 728 (8 %) cerebrovaskulární onemocnění. Výchozí průměrný krevní tlak byl 174/98 mmHg v obou léčebných skupinách. Průměrná délka sledování byla 4,8 roku. Na konci studie nebo při poslední návštěvě před primárním cílovým parametrem 77 % ze skupiny léčené přípravkem COZAAR 50 mg a 73 % ze skupiny léčené atenololem stále užívalo studijní medikaci. Z pacientů, kteří stále užívali studijní medikaci, byly průměrné dávky COZAARu a atenololu obě asi 80 mg/den a 15 % užívalo atenolol nebo losartan jako monoterapii, zatímco 77 % dostávalo také hydrochlorothiazid (v průměrné dávce 20 mg/den v každá skupina). Snížení krevního tlaku měřené na konci dne bylo podobné pro obě léčebné skupiny, ale krevní tlak nebyl měřen v žádnou jinou denní dobu. Na konci studie nebo při poslední návštěvě před primárním koncovým bodem byly průměrné krevní tlaky 144,1/81,3 mmHg ve skupině léčené přípravkem COZAAR a 145,4/80,9 mmHg ve skupině léčené atenololem; rozdíl v systolickém krevním tlaku (SBP) 1,3 mmHg byl významný (p
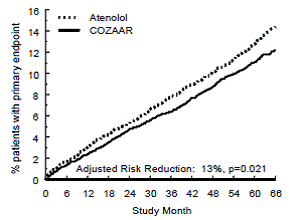
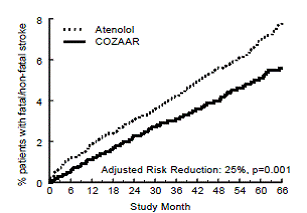
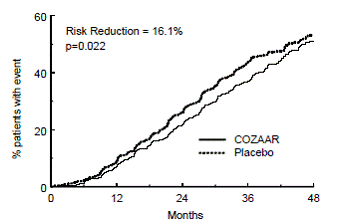
Primárním cílovým parametrem byl první výskyt kardiovaskulárního úmrtí, nefatální cévní mozkové příhody nebo nefatálního infarktu myokardu. Pacienti s nefatálními příhodami zůstávali ve zkoušce, takže byla také vyšetřena první příhoda každého typu, i když se nejednalo o první příhodu (např. mozková příhoda po počátečním infarktu myokardu by byla započítána do analýzy cévní mozkové příhody). Léčba přípravkem COZAAR 50 mg vedla k 13% snížení (p=0,021) rizika primárního koncového bodu ve srovnání se skupinou s atenololem (viz obrázek 1 a tabulka 3); tento rozdíl byl primárně výsledkem vlivu na fatální a nefatální mrtvici. Léčba přípravkem COZAAR snížila riziko mrtvice o 25 % ve srovnání s atenololem (p=0,001) (viz obrázek 2 a tabulka 3).
Obrázek 1: Kaplan-Meierovy odhady primárního koncového bodu času do kardiovaskulární smrti, nefatální cévní mozkové příhody nebo nefatálního infarktu myokardu ve skupinách léčených přípravkem COZAAR 100 mg a atenololem. Snížení rizika je upraveno podle výchozího skóre Framinghamského rizika a úrovně elektrokardiografické hypertrofie levé komory
Obrázek 2: Kaplan-Meierovy odhady doby do fatální/nefatální mozkové příhody ve skupinách léčených přípravkem COZAAR 50 mg a atenololem. Snížení rizika je upraveno podle výchozího skóre Framinghamského rizika a úrovně elektrokardiografické hypertrofie levé komory
Tabulka 3 ukazuje výsledky pro primární složený cílový bod a jednotlivé cílové parametry. Primárním cílovým parametrem byl první výskyt cévní mozkové příhody, infarktu myokardu nebo kardiovaskulárního úmrtí, analyzovaný pomocí přístupu ITT. Tabulka ukazuje počet událostí pro každou komponentu dvěma různými způsoby. Komponenty primárního koncového bodu (jako první událost) počítají pouze události, které definují primární koncový bod, zatímco sekundární koncové body počítají všechny první události určitého typu, ať už jim předcházel jiný typ události, nebo ne.
Ačkoli studie LIFE upřednostňovala COZAAR před atenololem s ohledem na primární cílový bod (p=0,021), tento výsledek pochází z jediné studie, a proto je méně přesvědčivý než rozdíl mezi COZAARem a placebem. I když to není měřeno přímo, rozdíl mezi COZAARem a placebem je přesvědčivý, protože existují důkazy, že atenolol je sám o sobě účinný (vs. placebo) při snižování kardiovaskulárních příhod, včetně mrtvice, u pacientů s hypertenzí.
Dalšími klinickými cíli studie LIFE byly: celková mortalita, hospitalizace pro srdeční selhání nebo anginu pectoris, koronární nebo periferní revaskularizační výkony a resuscitovaná srdeční zástava. Mezi skupinami užívajícími COZAAR a atenololem nebyly v četnosti těchto koncových bodů žádné významné rozdíly.
Pro primární cílový bod a cévní mozkovou příhodu jsou účinky přípravku COZAAR 25 mg u podskupin pacientů definovaných věkem, pohlavím, rasou a přítomností nebo nepřítomností izolované systolické hypertenze (ISH), diabetu a kardiovaskulárního onemocnění (CVD) v anamnéze znázorněny na obrázku 3 níže . Analýzy podskupin může být obtížné interpretovat a není známo, zda představují skutečné rozdíly nebo náhodné účinky.
Obrázek 3: Události primárního koncového bodu† v rámci demografických podskupin
Nefropatie u pacientů s diabetem 2. typu
Studie RENAAL byla randomizovaná, placebem kontrolovaná, dvojitě zaslepená, multicentrická studie prováděná po celém světě u 1513 pacientů s diabetem 2. typu s nefropatií (definovanou jako sérový kreatinin 1,3 až 3,0 mg/dl u žen nebo mužů ≤ 60 kg a 1,5 až 3,0 mg /dl u mužů >60 kg a proteinurie [poměr albuminu ke kreatininu v moči ≥300 mg/g]).
Pacienti byli randomizováni k užívání přípravku COZAAR 50 mg jednou denně nebo placeba na pozadí konvenční antihypertenzní terapie s výjimkou ACE inhibitorů a antagonistů angiotenzinu II. Po jednom měsíci byli zkoušející instruováni, aby titrovali studované léčivo na 100 mg jednou denně, pokud nebylo dosaženo cílové hodnoty krevního tlaku (140/90 mmHg). Celkově 72 % pacientů dostávalo 100mg denní dávku více než 50 % doby, kdy byli na studovaném léku. Vzhledem k tomu, že studie byla navržena tak, aby bylo dosaženo stejné kontroly krevního tlaku v obou skupinách, mohla být podle potřeby v obou skupinách přidána další antihypertenziva (diuretika, blokátory kalciových kanálů, alfa- nebo beta-blokátory a centrálně působící látky). Pacienti byli sledováni po průměrnou dobu 3,4 roku.
Populace ve studii byla různorodá s ohledem na rasu (Asiati 16,7 %, černoši 15,2 %, hispánci 18,3 %, běloši 48,6 %). Celkově 63,2 % pacientů byli muži a 66,4 % bylo mladších 65 let. Téměř všichni pacienti (96,6 %) měli v anamnéze hypertenzi a pacienti vstoupili do studie s průměrnou hodnotou sérového kreatininu 1,9 mg/dl a průměrnou proteinurií (albumin/kreatinin v moči) 1808 mg/g na začátku studie.
Primárním cílovým parametrem studie byl čas do prvního výskytu kterékoli z následujících příhod: zdvojnásobení sérového kreatininu, konečné stadium renálního onemocnění (ESRD) (potřeba dialýzy nebo transplantace) nebo smrt. Léčba přípravkem COZAAR vedla k 16% snížení rizika v tomto koncovém bodě (viz Obrázek 4 a Tabulka 4). Léčba přípravkem COZAAR také snížila výskyt trvalého zdvojnásobení sérového kreatininu o 25 % a ESRD o 29 % jako samostatné koncové body, ale neměla žádný vliv na celkovou mortalitu (viz tabulka 4).
Průměrné výchozí krevní tlaky byly 152/82 mmHg pro COZAAR plus konvenční antihypertenzní léčbu a 153/82 mmHg pro placebo plus konvenční antihypertenzní léčbu. Na konci studie byly průměrné krevní tlaky 143/76 mmHg pro skupinu léčenou přípravkem COZAAR 100 mg a 146/77 mmHg pro skupinu léčenou placebem.
Obrázek 4: Kaplan-Meierova křivka pro primární složený cílový bod zdvojnásobení sérového kreatininu, konečné stadium onemocnění ledvin (potřeba dialýzy nebo transplantace) nebo úmrtí
Sekundárními cílovými body studie byla změna proteinurie, změna rychlosti progrese onemocnění ledvin a kombinace morbidity a mortality z kardiovaskulárních příčin (hospitalizace pro srdeční selhání, infarkt myokardu, revaskularizace, cévní mozková příhoda, hospitalizace pro nestabilní anginu pectoris nebo kardiovaskulární Ve srovnání s placebem COZAAR významně snížil proteinurii v průměru o 34 %, což je účinek, který byl zřejmý do 3 měsíců od zahájení léčby, a významně snížil míru poklesu glomerulární filtrace během studie o 13 %, jak bylo měřeno reciproční koncentrace sérového kreatininu. Nebyl žádný významný rozdíl v incidenci složeného cílového parametru kardiovaskulární morbidity a mortality.
Příznivé účinky přípravku COZAAR byly pozorovány u pacientů užívajících také další antihypertenziva (antagonisté receptoru angiotenzinu II a inhibitory angiotenzin konvertujícího enzymu nebyly povoleny), perorální hypoglykemika a hypolipidemika.
Pro primární cílový ukazatel a ESRD jsou účinky přípravku COZAAR u podskupin pacientů definovaných věkem, pohlavím a rasou uvedeny v tabulce 5 níže. Analýzy podskupin může být obtížné interpretovat a není známo, zda představují skutečné rozdíly nebo náhodné účinky.
INFORMACE PRO PACIENTA
COZAAR® (CO-zar) (draselná sůl losartanu tablety) 25 mg, 50 mg, 100 mg
Přečtěte si informace pro pacienty, které jsou dodávány s COZAARem, než jej začnete užívat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tato příbalová informace nenahrazuje rozhovor s lékařem o vašem stavu a léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o COZAAR?
- COZAAR může způsobit poškození nebo smrt nenarozeného dítěte.
- Pokud plánujete otěhotnět, poraďte se se svým lékařem o dalších způsobech, jak snížit krevní tlak.
- Pokud otěhotníte během užívání přípravku COZAAR, informujte o tom ihned svého lékaře.
Co je COZAAR 100 mg?
COZAAR 100 mg je lék na předpis nazývaný blokátor receptoru pro angiotenzin (ARB). Používá se:
- samostatně nebo s jinými léky na snížení vysokého krevního tlaku (hypertenze).
- ke snížení pravděpodobnosti cévní mozkové příhody u pacientů s vysokým krevním tlakem a srdečním problémem zvaným hypertrofie levé komory. COZAAR nemusí pomoci černošským pacientům s tímto problémem.
- ke zpomalení zhoršování diabetického onemocnění ledvin (nefropatie) u pacientů s diabetem 2. typu, kteří mají nebo měli vysoký krevní tlak.
COZAAR 25 mg nebyl studován u dětí mladších 6 let nebo u dětí s určitými ledvinovými problémy.
Vysoký krevní tlak (hypertenze) Krevní tlak je síla ve vašich krevních cévách, když vaše srdce bije a když vaše srdce odpočívá. Máte vysoký krevní tlak, když je síla příliš velká. COZAAR 25 mg může pomoci uvolnit krevní cévy a snížit tak krevní tlak.
Hypertrofie levé komory (LVH) je zvětšení stěn levé komory srdce (hlavní čerpací komory srdce). LVH se může stát z několika věcí. Vysoký krevní tlak je nejčastější příčinou LVH.
Diabetes typu 2 s nefropatií . Diabetes typu 2 je typ cukrovky, který se vyskytuje hlavně u dospělých. Pokud máte diabetickou nefropatii, znamená to, že vaše ledviny nefungují správně kvůli poškození cukrovkou.
Kdo by neměl užívat přípravek COZAAR 100 mg?
- Neužívejte přípravek COZAAR 25 mg, pokud jste alergický/á na kteroukoli složku přípravku COZAAR . Úplný seznam složek přípravku COZAAR naleznete na konci této příbalové informace.
- Neužívejte přípravek COZAAR, pokud máte cukrovku a užíváte lék zvaný aliskiren ke snížení krevního tlaku.
Co mám říci svému lékaři, než začnu užívat přípravek COZAAR 50 mg?
Informujte svého lékaře o všech svých zdravotních stavech, včetně pokud:
- jste těhotná nebo těhotenství plánujete. viz " Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku COZAAR 25 mg? "
- kojí . Není známo, zda COZAAR 50 mg přechází do vašeho mateřského mléka. Měla byste si vybrat buď užívat přípravek COZAAR 50 mg, nebo kojit, ale ne obojí.
- hodně zvracíte nebo máte velký průjem
- mít problémy s játry
- mít problémy s ledvinami
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků. COZAAR a některé další léky se mohou vzájemně ovlivňovat. Zejména informujte svého lékaře, pokud užíváte:
- doplňky draslíku
- náhražky soli obsahující draslík
- jiné léky, které mohou zvýšit hladinu draslíku v séru
- pilulky na vodu (diuretika)
- lithium (lék používaný k léčbě určitého druhu deprese)
- léky používané k léčbě bolesti a artritidy, nazývané nesteroidní protizánětlivé léky (NSAID), včetně inhibitorů COX-2
- jiné léky na snížení krevního tlaku
Jak mám užívat přípravek COZAAR 25 mg?
- Užívejte COZAAR 100 mg přesně podle pokynů svého lékaře. Váš lékař může v případě potřeby změnit dávku.
- COZAAR 50 mg lze užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku, užijte ji, jakmile si vzpomenete. Pokud se blížíte k další dávce, zapomenutou dávku neužívejte. Užijte si další dávku v obvyklou dobu.
- Pokud užijete příliš mnoho přípravku COZAAR, zavolejte svého lékaře nebo Poison Control Center nebo jděte ihned na pohotovost v nejbližší nemocnici.
Jaké jsou možné vedlejší účinky přípravku COZAAR?
COZAAR 25 mg může způsobit následující nežádoucí účinky, které mohou být závažné:
- Zranění nebo smrt nenarozených dětí. Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o COZAAR?"
- Alergická reakce Příznaky alergické reakce jsou otok obličeje, rtů, hrdla nebo jazyka. Okamžitě vyhledejte lékařskou pomoc a přestaňte užívat přípravek COZAAR.
- Nízký krevní tlak (hypotenze) . Nízký krevní tlak může způsobit pocit na omdlení nebo závratě. Lehněte si, pokud máte pocit na omdlení nebo závratě. Okamžitě zavolejte svému lékaři.
- U lidí, kteří již mají problémy s ledvinami, můžete zaznamenat zhoršení toho, jak dobře vaše ledviny fungují. Zavolejte svého lékaře, pokud máte otoky nohou, kotníků nebo rukou nebo nevysvětlitelné zvýšení hmotnosti.
- Vysoká hladina draslíku v krvi
Nejčastějšími nežádoucími účinky přípravku COZAAR 50 mg u lidí s vysokým krevním tlakem jsou:
- "nachlazení" (infekce horních cest dýchacích)
- závrať
- ucpaný nos
- bolesti zad
Nejčastější nežádoucí účinky přípravku COZAAR 50 mg u lidí s diabetem 2. typu s diabetickým onemocněním ledvin jsou:
- průjem
- únava
- nízká hladina cukru v krvi
- bolest na hrudi
- vysoká hladina draslíku v krvi
- nízký krevní tlak
Informujte svého lékaře, pokud zaznamenáte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který nezmizí.
Tohle je ne kompletní seznam vedlejších účinků. Úplný seznam získáte od svého lékaře nebo lékárníka.
Jak mám COZAAR 100 mg uchovávat?
- Tablety COZAAR uchovávejte při teplotě 59 °F až 86 °F (15 °C až 30 °C).
- COZAAR uchovávejte v těsně uzavřeném obalu, který chrání přípravek před světlem.
- Uchovávejte COZAAR a všechny léky mimo dosah dětí.
Obecné informace o COZAAR
Léky jsou někdy předepisovány na stavy, které nejsou uvedeny v příbalových informacích pro pacienty. Nepoužívejte přípravek COZAAR pro stav, pro který nebyl předepsán. Nedávejte COZAAR jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták shrnuje nejdůležitější informace o COZAAR. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékárníka nebo lékaře o informace o přípravku COZAAR, který je určen pro zdravotníky.
Jaké jsou složky přípravku COZAAR 25 mg?
Účinné látky: losartan draselný
Neaktivní složky:
mikrokrystalická celulóza, hydratovaná laktóza, předbobtnalý škrob, magnesium-stearát, hydroxypropylcelulóza, hypromelóza a oxid titaničitý. COZAAR 25 mg, COZAAR 50 mg a COZAAR 100 mg mohou také obsahovat karnaubský vosk.
