Adalat 10mg, 20mg, 30mg Nifedipine Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Adalat a jak se používá?
Adalat je lék na předpis používaný k léčbě příznaků bolesti na hrudi (angina pectoris), vysokého krevního tlaku (hypertenze) a plicní hypertenze. Adalat 30 mg lze užívat samostatně nebo s jinými léky.
Adalat 20 mg patří do třídy léků nazývaných blokátory vápníkových kanálů; Blokátory vápníkových kanálů, dihydropyridin.
Není známo, zda je přípravek Adalat 30 mg bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Adalat 10 mg?
Adalat může způsobit závažné nežádoucí účinky, včetně:
- kopřivka,
- potíže s dýcháním,
- otok v obličeji nebo krku,
- horečka,
- bolest krku,
- pálení očí,
- bolest kůže,
- červená nebo fialová kožní vyrážka s puchýři a olupováním,
- zhoršující se bolest na hrudi,
- bušení srdce,
- chvění v tvé hrudi,
- točení hlavy,
- otoky rukou nebo dolních končetin,
- bolest v horní části žaludku a
- zežloutnutí kůže nebo očí (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky Adalatu patří:
- otok,
- návaly horka (teplo, zarudnutí nebo pocit brnění),
- bolest hlavy,
- závrať,
- nevolnost,
- pálení žáhy a
- pocit slabosti nebo únavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Adalatu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Adalat® CC je tabletová léková forma s prodlouženým uvolňováním blokátoru kalciových kanálů nifedipinu. Nifedipin je 1,4-dihydro-2,6-dimethyl-4-(2-nitrofenyl)-dimethylester 3,5-pyridindikarboxylové kyseliny, C17H18N2O6, a má strukturní vzorec:
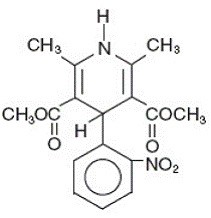
Nifedipin je žlutá krystalická látka, prakticky nerozpustná ve vodě, ale rozpustná v ethanolu. Má molekulovou hmotnost 346,3. Tablety Adalat CC se skládají z vnějšího obalu a vnitřního jádra. Oba obsahují nifedipin, potah jako přípravek s pomalým uvolňováním a jádro jako přípravek s rychlým uvolňováním. Tablety Adalat CC obsahují buď: 30, 60 nebo 90 mg nifedipinu pro perorální podání jednou denně.
Inertní složky ve formulaci jsou: hydroxypropylcelulóza, laktóza, kukuřičný škrob, krospovidon, mikrokrystalická celulóza, oxid křemičitý a stearát hořečnatý. Inertní složky ve filmovém potahu pro Adalat 30 mg CC 30 a 60 jsou: hypromelóza, polyethylenglykol, oxid železitý a oxid titaničitý. Inertní složky ve filmovém potahu pro Adalat 20 mg CC 90 jsou: hypromelóza, polyethylenglykol a oxid železitý
INDIKACE
Adalat 10 mg CC je indikován k léčbě hypertenze. Může být použit samostatně nebo v kombinaci s jinými antihypertenzivy.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávkování by mělo být upraveno podle potřeb každého pacienta. Adalat 20 mg CC se doporučuje podávat perorálně jednou denně nalačno. Adalat 10mg CC je léková forma s prodlouženým uvolňováním a tablety by se měly polykat celé, nekousat nebo dělit. Obecně by titrace měla probíhat po dobu 7-14 dnů počínaje dávkou 30 mg jednou denně. Titrace směrem nahoru by měla být založena na terapeutické účinnosti a bezpečnosti. Obvyklá udržovací dávka je 30 mg až 60 mg jednou denně. Titrace na dávky nad 90 mg denně se nedoporučuje.
Je-li nutné vysazení přípravku Adalat 30 mg CC, řádná klinická praxe naznačuje, že dávkování by mělo být snižováno postupně pod přísným dohledem lékaře.
Je třeba se vyhnout současnému podávání nifedipinu s grapefruitovou šťávou (viz KLINICKÁ FARMAKOLOGIE a OPATŘENÍ ).
Při výdeji přípravku Adalat CC je třeba dbát na to, aby byla předepsána léková forma s prodlouženým uvolňováním.
JAK DODÁVÁNO
Adalat CC tablety s prodlouženým uvolňováním se dodávají jako kulaté potahované tablety 30 mg, 60 mg a 90 mg. Různé silné stránky lze identifikovat následovně:
Adalat® CC tablety jsou dodávány v:
Tablety je třeba chránit před světlem a vlhkostí a uchovávat při teplotě do 30 °C. Dávkujte v těsných, světlu odolných nádobách.
Vyrobeno pro: Bayer HealthCare Pharmaceuticals Inc., Wayne, NJ 07470. Vyrobeno v Německu. Revize: prosinec 2015
VEDLEJŠÍ EFEKTY
Nežádoucí zkušenosti
Výskyt nežádoucích účinků během léčby přípravkem Adalat CC v dávkách až 90 mg denně byl odvozen z multicentrických placebem kontrolovaných klinických studií u 370 pacientů s hypertenzí. Atenolol 50 mg jednou denně byl použit současně u 187 z 370 pacientů na Adalatu CC a u 64 ze 126 pacientů na placebu. Všechny nežádoucí příhody hlášené během léčby Adalatem 30 mg CC byly uvedeny v tabulce nezávisle na jejich kauzálním vztahu k medikaci.
Nejčastější nežádoucí příhodou hlášenou u přípravku Adalat 10 mg CC byl periferní edém. To bylo závislé na dávce a frekvence byla 18 % u Adalatu 30 mg CC 30 mg denně, 22 % u Adalatu 30 mg CC 60 mg denně a 29 % u Adalatu 10 mg CC 90 mg denně oproti 10 % u placeba.
Mezi další časté nežádoucí účinky hlášené ve výše uvedených placebem kontrolovaných studiích patří:
Pokud je frekvence nežádoucích účinků u přípravku Adalat 20 mg CC a placeba podobná, nelze stanovit příčinnou souvislost.
Následující nežádoucí účinky byly hlášeny s incidencí 3 % nebo méně v denních dávkách do 90 mg:
Tělo jako celek/systém: bolest na hrudi, bolest nohou
Centrální nervový systém: parestézie, vertigo
Dermatologické: vyrážka
Gastrointestinální: zácpa
Muskuloskeletální: křeče v nohou
Respirační: epistaxe, rýma
Urogenitální: impotence, frekvence močení
Další nežádoucí účinky hlášené s incidencí nižší než 1,0 % byly:
Tělo jako celek/systém: alergická reakce, astenie, celulitida, substernální bolest na hrudi, zimnice, edém obličeje, abnormální laboratorní testy, malátnost, bolest šíje, pánevní bolest, bolest, fotosenzitivní reakce Kardiovaskulární: fibrilace síní, bradykardie, srdeční zástava, extrasystole, hypotenze, migréna, palpitace , flebitida, posturální hypotenze, tachykardie, kožní angiektázy
Centrální nervový systém: úzkost, zmatenost, snížené libido, deprese, hypertonie, hypestezie, nespavost, somnolence
Dermatologické: angioedém, petechiální vyrážka, pruritus, pocení
Gastrointestinální: bolest břicha, průjem, sucho v ústech, dysfagie, dyspepsie, říhání, ezofagitida, plynatost, gastrointestinální poruchy, gastrointestinální krvácení, zvýšení GMT, poruchy dásní, krvácení z dásní, zvracení
Hematologické: eozinofilie, lymfadenopatie
Metabolické: dna, hubnutí
Muskuloskeletální: artralgie, artritida, onemocnění kloubů, myalgie, myastenie
Respirační: dušnost, zvýšený kašel, chrochtání, faryngitida, stridor
Speciální smysly: abnormální vidění, amblyopie, konjunktivitida, diplopie, oční poruchy, oční krvácení, tinitus
Urogenitální/reprodukční: dysurie, ledvinový kámen, nykturie, překrvení prsů, polyurie, urogenitální porucha, erektilní dysfunkce (ED)
Následující nežádoucí účinky byly vzácně hlášeny u pacientů, kterým byl podáván nifedipin v jádru pláště nebo v jiných formulacích: alergenní hepatitida, alopecie, anafylaktická reakce, anémie, artritida s ANA (+), deprese, erytromelalgie, exfoliativní dermatitida, horečka, gingivální hyperplazie, gynekomastie, hyperglykémie, žloutenka, leukopenie, změny nálady, svalové křeče, nervozita, paranoidní syndrom, purpura, třes, poruchy spánku, Stevens-Johnsonův syndrom, synkopa, perverze chuti, trombocytopenie, toxická epidermální nekrolýza, přechodná slepota na vrcholu plazmatické hladiny, třes a kopřivka.
DROGOVÉ INTERAKCE
Nifedipin je eliminován hlavně metabolismem a je substrátem CYP3A. Inhibitory a induktory CYP3A mohou ovlivnit expozici nifedipinu a následně jeho žádoucí a nežádoucí účinky. Údaje in vitro a in vivo naznačují, že nifedipin může inhibovat metabolismus léků, které jsou substráty CYP3A, a tím zvýšit expozici jiným lékům. Nifedipin je vazodilatátor a současné podávání jiných léků ovlivňujících krevní tlak může vést k farmakodynamickým interakcím.
Inhibitory CYP3A
Inhibitory CYP3A, jako je ketokonazol, flukonazol, itrakonazol, klarithromycin, erythromycin (azithromycin, ačkoli strukturálně příbuzný třídě makrolidových antibiotik nemá klinicky významnou inhibici CYP3A4), grapefruit, nefazodon, fluoxetin, saquinavir, indinavir a mayritonavir, nelfina při zvýšené expozici nifedipinu při současném podávání. Může být nezbytné pečlivé sledování a úprava dávky; zvážit zahájení léčby nifedipinem v nejnižší dostupné dávce, pokud je podáván současně s těmito léky.
Silné induktory CYP3A
Silné induktory CYP3A, jako je rifampin, rifabutin, fenobarbital, fenytoin, karbamazepin a třezalka tečkovaná snižují biologickou dostupnost a účinnost nifedipinu; proto by nifedipin neměl být používán v kombinaci se silnými induktory CYP3A, jako je rifampin (viz KONTRAINDIKACE ).
Kardiovaskulární léky
Antiarytmika
chinidin: Chinidin je substrátem CYP3A a bylo prokázáno, že inhibuje CYP3A in vitro. Současné podávání více dávek chinidinsulfátu 200 mg třikrát denně a nifedipinu 20 mg třikrát denně zvýšilo Cmax a AUC nifedipinu u zdravých dobrovolníků faktorem 2,30 a 1,37, v tomto pořadí. Srdeční frekvence v počátečním intervalu po podání léku byla zvýšena až o 17,9 tepů/minutu. Expozice chinidinu se v přítomnosti nifedipinu významně nezměnila. Při přidávání chinidinu k léčbě nifedipinem se doporučuje monitorování srdeční frekvence a v případě potřeby úprava dávky nifedipinu.
Flekainid: Se současným podáváním Tambocoru a nifedipinu je příliš málo zkušeností, než aby bylo možné doporučit současné užívání.
Blokátory vápníkových kanálů
Diltiazem: Předléčení zdravých dobrovolníků 30 mg nebo 90 mg třikrát denně diltiazemu po zvýšilo AUC nifedipinu po jedné dávce 20 mg nifedipinu faktorem 2,2 a 3,1. Odpovídající hodnoty Cmax nifedipinu se zvýšily faktorem 2,0 a 1,7. Při současném podávání diltiazemu a nifedipinu je třeba postupovat opatrně a je třeba zvážit snížení dávky nifedipinu.
verapamil: Verapamil, inhibitor CYP3A, může inhibovat metabolismus nifedipinu a zvýšit expozici nifedipinu během souběžné léčby. Je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
ACE inhibitory
Benazepril: zdravých dobrovolníků, kteří dostávali jednorázovou dávku 20 mg nifedipinu ER a benazeprilu 10 mg, nebyly plazmatické koncentrace benazeprilátu a nifedipinu ve vzájemné přítomnosti a nepřítomnosti statisticky významně odlišné. Hypotenzní účinek byl pozorován pouze po současném podávání těchto dvou léků. Tachykardický účinek nifedipinu byl zeslaben v přítomnosti benazeprilu.
Blokátory angiotenzinu II
Irbesartan: Studie in vitro ukazují významnou inhibici tvorby oxidovaných metabolitů irbesartanu nifedipinem. V klinických studiích však současné podávání nifedipinu nemělo žádný vliv na farmakokinetiku irbesartanu.
Candesartan: Ve studiích s kandesartanem cilexitilem podávaným společně s nifedipinem nebyly hlášeny žádné významné lékové interakce. Protože kandesartan není významně metabolizován systémem cytochromu P450 a v terapeutických koncentracích nemá žádný účinek na enzymy cytochromu P450, nelze očekávat interakce s léky, které tyto enzymy inhibují nebo jsou těmito enzymy metabolizovány.
Beta-blokátory
Adalat 10 mg CC byl dobře tolerován, když byl podáván v kombinaci s beta-blokátory u 187 pacientů s hypertenzí v placebem kontrolované klinické studii. V literatuře se však občas objevily zprávy naznačující, že kombinace nifedipinu a beta-adrenergních blokátorů může zvýšit pravděpodobnost městnavého srdečního selhání, těžké hypotenze nebo exacerbace anginy pectoris u pacientů s kardiovaskulárním onemocněním. Doporučuje se klinické sledování a je třeba zvážit úpravu dávky nifedipinu.
Timolol: Hypotenze je pravděpodobnější, pokud jsou antagonisté kalcia dihydropriridinu, jako je nifedipin, podáváni současně s timololem.
Centrální alfa1-blokátory
Doxazosin: Zdraví dobrovolníci účastnící se studie interakce doxazosin-nifedipin s opakovanými dávkami dostávali 2 mg doxazosinu qd samostatně nebo v kombinaci s 20 mg nifedipinu ER dvakrát denně Současné podávání nifedipinu vedlo ke snížení AUC a Cmax doxazosinu na 83 % a 86 % hodnot v nepřítomnosti nifedipinu, resp. V přítomnosti doxazosinu byly AUC a Cmax nifedipinu zvýšeny faktorem 1,13 a 1,23. Ve srovnání s monoterapií nifedipinem byl krevní tlak nižší v přítomnosti doxazosinu. Při současném podávání doxazosinu s nifedipinem je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
Digitální
digoxin: Současné podávání nifedipinu a digoxinu může vést ke snížení clearance vedoucí ke zvýšení plazmatických koncentrací digoxinu. Vzhledem k tomu, že byly ojediněle hlášeny případy pacientů se zvýšenými hladinami digoxinu a existuje možná interakce mezi digoxinem a Adalatem CC, doporučuje se monitorovat hladiny digoxinu při zahájení, úpravě a vysazení přípravku Adalat 10 mg CC, aby se předešlo možnému nadměrnému nebo nižšímu digitalizace.
Antitrombotika
kumariny: Vzácně byly hlášeny případy zvýšeného protrombinového času u pacientů užívajících kumarinová antikoagulancia, kterým byl podáván nifedipin. Nicméně vztah k léčbě nifedipinem je nejistý.
Inhibitory agregace krevních destiček
klopidogrel: Při současném podávání klopidogrelu s nifedipinem nebyly pozorovány žádné klinicky významné farmakodynamické interakce.
Tirofiban: Současné podávání nifedipinu významně nezměnilo expozici tirofibanu.
jiný
Diuretika, inhibitory PDE5, alfa-methyldopa: Nifedipin může zvýšit účinek těchto současně podávaných látek na snížení krevního tlaku.
Nekardiovaskulární léky
Antifungální léky
Ketokonazol, itrakonazol a flukonazol jsou inhibitory CYP3A a mohou inhibovat metabolismus nifedipinu a zvýšit expozici nifedipinu během souběžné léčby. Je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
Antisekreční léky
omeprazol: U zdravých dobrovolníků, kteří dostávali jednorázovou dávku 10 mg nifedipinu, byly AUC a Cmax nifedipinu po předběžné léčbě omeprazolem 20 mg qd po dobu 8 dnů 1,26krát a 0,87krát vyšší než po předchozí léčbě placebem. Předběžná léčba nebo současné podávání omeprazolu neovlivnilo účinek nifedipinu na krevní tlak nebo srdeční frekvenci. Vliv omeprazolu na nifedipin pravděpodobně nebude mít klinický význam.
Pantoprazol: zdravých dobrovolníků nebyla expozice žádnému léku významně změněna v přítomnosti druhého léku.
ranitidin: Pět studií na zdravých dobrovolnících zkoumalo dopad opakovaných dávek ranitidinu na farmakokinetiku nifedipinu po jednorázové nebo opakované dávce. Dvě studie zkoumaly vliv souběžně podávaného ranitidinu na krevní tlak u hypertoniků na nifedipinu. Současné podávání ranitidinu nemělo relevantní účinky na expozici nifedipinu, která ovlivňovala krevní tlak nebo srdeční frekvenci u normotenzních nebo hypertenzních subjektů.
Cimetidin: Pět studií na zdravých dobrovolnících zkoumalo dopad opakovaných dávek cimetidinu na farmakokinetiku nifedipinu po jednorázové nebo opakované dávce. Dvě studie zkoumaly vliv souběžně podávaného cimetidinu na krevní tlak u hypertoniků na nifedipinu. U normotenzních jedinců, kteří dostávali jednotlivé dávky 10 mg nebo opakované dávky až 20 mg nifedipinu třikrát denně samostatně nebo společně s cimetidinem až do dávky 1000 mg/den, byly hodnoty AUC nifedipinu v přítomnosti cimetidinu mezi 1,52 a 2,01 násobky hodnot v nepřítomnost cimetidinu. Hodnoty Cmax nifedipinu v přítomnosti cimetidinu byly zvýšeny faktory v rozmezí 1,60 až 2,02. Zvýšení expozice nifedipinu cimetidinem bylo doprovázeno relevantními změnami krevního tlaku nebo srdeční frekvence u normotenzních subjektů. U pacientů s hypertenzí, kteří dostávali 10 mg qd nifedipinu samostatně nebo v kombinaci s cimetidinem 1000 mg qd, také došlo k relevantním změnám krevního tlaku, když byl cimetidin přidán k nifedipinu. Interakce mezi cimetidinem a nifedipinem má klinický význam a je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
cisaprid: Současné podávání cisapridu a nifedipinu může vést ke zvýšení plazmatických koncentrací nifedipinu.
Antibakteriální léky
Quinupristin/Dalfopristin: Studie lékových interakcí in vitro prokázaly, že quinupristin/dalfopristin významně inhibuje CYP3A metabolismus nifedipinu. Současné podávání quinupristinu/dalfopristinu a nifedipinu (opakovaná perorální dávka) zdravým dobrovolníkům zvýšilo AUC a Cmax nifedipinu o faktory 1,44 a 1,18 ve srovnání s monoterapií nifedipinem. Při současném podávání quinupristinu/dalfopristinu s nifedipinem je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
Erythromycin: Erythromycin, inhibitor CYP3A, může inhibovat metabolismus nifedipinu a zvýšit expozici nifedipinu během souběžné léčby. Je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
Antituberkulární léky
rifampin: Silné induktory CYP3A, jako je rifampin, rifapentin a rifabutin, snižují biologickou dostupnost nifedipinu, což může snížit účinnost nifedipinu; proto by nifedipin neměl být používán v kombinaci se silnými induktory CYP3A, jako je rifampin (viz KONTRAINDIKACE ). V klinické studii byl hodnocen vliv vícenásobných perorálních dávek 600 mg rifampinu na farmakokinetiku nifedipinu po jednorázové perorální dávce 20 mg nifedipinové tobolky. Dvanáct zdravých mužských dobrovolníků dostalo jednu perorální dávku 20 mg tobolky nifedipinu v den studie. Počínaje dnem studie 2 subjekty dostávaly 600 mg rifampinu jednou denně po dobu 14 dnů. V den studie 15 byla podána druhá jednotlivá perorální dávka 20 mg tobolky nifedipinu společně s poslední dávkou rifampinu. Ve srovnání s 1. dnem studie snížilo 14denní předléčení rifampinem Cmax a AUC současně podávaného nifedipinu v průměru o 95 % a 97 %, v tomto pořadí.

Antivirová léčiva
Amprenavir, atanazavir, delavirin, fosamprinavir, indinavir, nelfinavir a ritonavir, jako inhibitory CYP3A, mohou inhibovat metabolismus nifedipinu a zvýšit expozici nifedipinu. Je nutná opatrnost a doporučuje se klinické sledování pacientů.
CNS léky
Nefazodon, inhibitor CYP3A, může inhibovat metabolismus nifedipinu a zvýšit expozici nifedipinu během souběžné léčby. Je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
Fluoxetin, inhibitor CYP3A, může inhibovat metabolismus nifedipinu a zvýšit expozici nifedipinu během souběžné léčby. Je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
Kyselina valproová může během souběžné léčby zvýšit expozici nifedipinu. Je třeba monitorovat krevní tlak a zvážit snížení dávky nifedipinu.
Fenytoin, fenobarbital a karbamazepin: Nifedipin je metabolizován CYP3A. Současné podávání nifedipinu 10 mg tobolky a 60 mg nifedipinové tablety s jádrem a fenytoinem, induktorem CYP3A, snížilo AUC a Cmax nifedipinu přibližně o 70 %. Fenobarbital a karbamazepin jsou také induktory CYP3A. U pacientů užívajících fenytoin, fenobarbital a karbamazepin je třeba zvážit alternativní antihypertenzní léčbu.
Antiemetika
Dolasetron: U pacientů užívajících dolasetron perorálně nebo intravenózně a nifedipin nebyl prokázán žádný účinek na clearance hydrodolasetronu.
Imunosupresivní léky
Takrolimus: Bylo prokázáno, že takrolimus je metabolizován systémem CYP3A. Bylo prokázáno, že nifedipin inhibuje metabolismus takrolimu in vitro. Pacienti po transplantaci, kterým byl podáván takrolimus a nifedipin, vyžadovali o 26 % až 38 % nižší dávky než pacienti, kteří nifedipin nedostávali. Nifedipin může zvýšit expozici takrolimu. Při současném podávání nifedipinu s takrolimem je třeba monitorovat krevní koncentrace takrolimu a zvážit snížení dávky takrolimu.
Sirolimus: Jedna 60mg dávka nifedipinu a jedna 10mg dávka sirolimu perorálního roztoku byla podána 24 zdravým dobrovolníkům. Klinicky významné farmakokinetické lékové interakce nebyly pozorovány.
Léky na snížení hladiny glukózy
Pioglitazon: Současné podávání pioglitazonu po dobu 7 dnů s 30 mg nifedipinu ER podávaným perorálně qd po dobu 4 dnů dobrovolníkům mužů a žen vedlo k průměrným hodnotám nejmenších čtverců (90% CI) pro nezměněný nifedipin 0,83 (0,73-0,95) pro Cmax a 0,88 ( 0,80-0,96) pro AUC vzhledem k monoterapii nifedipinem. Vzhledem k vysoké variabilitě farmakokinetiky nifedipinu není klinický význam tohoto zjištění znám.
Rosiglitazon: Ukázalo se, že současné podávání rosiglitazonu (4 mg dvakrát denně) nemá žádný klinicky významný účinek na farmakokinetiku nifedipinu.
Metformin: Studie interakce metformin-nifedipin s jednorázovou dávkou u normálních zdravých dobrovolníků prokázala, že současné podávání nifedipinu zvýšilo Cmax metforminu v plazmě o 20 % a AUC o 9 % a zvýšilo množství metforminu vyloučeného močí. Tmax a poločas nebyly ovlivněny. Zdá se, že nifedipin zvyšuje absorpci metforminu.
miglitol: Nebyl pozorován žádný účinek miglitolu na farmakokinetiku a farmakodynamiku nifedipinu.
Repaglinid: Současné podávání 10 mg nifedipinu s jednorázovou dávkou 2 mg repaglinidu (po 4 dnech nifedipinu 10 mg třikrát denně a repaglinidu 2 mg třikrát denně) vedlo k nezměněným hodnotám AUC a Cmax pro obě léčiva.
akarbóza: Nifedipin má tendenci vyvolat hyperglykémii a může vést ke ztrátě kontroly glukózy. Pokud je nifedipin podáván současně s akarbózou, je třeba pečlivě sledovat hladiny glukózy v krvi a zvážit úpravu dávky nifedipinu.
Léky narušující vstřebávání potravy
Orlistat: U 17 jedinců s normální hmotností, kteří dostávali orlistat 120 mg třikrát denně po dobu 6 dnů, orlistat nezměnil biologickou dostupnost 60 mg nifedipinu (tablety s prodlouženým uvolňováním).
Doplňky stravy
Grepový džus: zdravých dobrovolníků jednorázové současné podání 250 ml dvojité grapefruitové šťávy s 10 mg nifedipinu zvýšilo AUC a Cmax faktorem 1,35 a 1,13. Požití opakovaných dávek grapefruitové šťávy (5 x 200 ml za 12 hodin) po podání 20 mg nifedipinu ER zvýšilo AUC a Cmax nifedipinu faktorem 2. Pacienti užívající nifedipin by se grapefruitové šťávě měli vyhýbat. Příjem grapefruitové šťávy by měl být ukončen nejméně 3 dny před zahájením léčby nifedipinem u pacientů.
Byliny
Třezalka tečkovaná: Třezalka tečkovaná je induktorem CYP3A a může snížit expozici nifedipinu. U pacientů, u kterých je léčba třezalkou tečkovaná, je třeba zvážit alternativní antihypertenzní léčbu.
CYP2D6 sondový lék
Debrisoquin: zdravých dobrovolníků nezměnilo předléčení nifedipinem 20 mg třikrát denně po dobu 5 dnů metabolický poměr hydroxydebrisochinu k debrisochinu měřený v moči po jednorázové dávce 10 mg debrisochinu. Je tedy nepravděpodobné, že by nifedipin in vivo inhiboval metabolismus jiných léků, které jsou substráty CYP2D6.
VAROVÁNÍ
Nadměrná hypotenze
Ačkoli u většiny pacientů je hypotenzní účinek nifedipinu mírný a dobře tolerovaný, příležitostní pacienti měli nadměrnou a špatně tolerovanou hypotenzi. Tyto odpovědi se obvykle objevily během počáteční titrace nebo v době následné úpravy dávky směrem nahoru a mohou být pravděpodobnější u pacientů užívajících současně betablokátory.
Těžká hypotenze a/nebo zvýšené požadavky na objem tekutin byly hlášeny u pacientů, kteří dostávali tobolky s okamžitým uvolňováním spolu s beta-blokátorem a kteří podstoupili bypass koronární artérie za použití vysoké dávky anestezie fentanylem. Zdá se, že interakce s vysokou dávkou fentanylu je způsobena kombinací nifedipinu a beta-blokátoru, ale možnost, že se může objevit u samotného nifedipinu, s nízkými dávkami fentanylu, při jiných chirurgických zákrocích nebo s jinými narkotickými analgetiky, nemůže být vyloučeno. U pacientů léčených nifedipinem, kde se uvažuje o chirurgickém zákroku s použitím vysoké dávky anestezie fentanylem, by si lékař měl být vědom těchto potenciálních problémů, a pokud to stav pacienta dovolí, měl by být poskytnut dostatečný čas (nejméně 36 hodin) na vymytí nifedipinu tělo před operací.
Zvýšená angina pectoris a/nebo infarkt myokardu
Vzácně se u pacientů, zvláště u těch, kteří mají těžkou obstrukční chorobu koronárních tepen, vyvinula dobře zdokumentovaná zvýšená frekvence, trvání a/nebo závažnost anginy pectoris nebo akutního infarktu myokardu po zahájení léčby nifedipinem nebo v době zvýšení dávky. Mechanismus tohoto účinku není stanoven.
Stažení beta-blokátoru
Při vysazování beta-blokátoru je důležité snížit jeho dávku, pokud je to možné, spíše než náhle vysadit před zahájením léčby nifedipinem. U pacientů nedávno vysazených z betablokátorů se může rozvinout abstinenční syndrom se zvýšenou anginou pectoris, pravděpodobně související se zvýšenou citlivostí na katecholaminy. Zahájení léčby nifedipinem tomuto výskytu nezabrání a příležitostně bylo hlášeno jeho zvýšení.
Městnavé srdeční selhání
Vzácně se u pacientů (obvykle během užívání beta-blokátoru) po zahájení léčby nifedipinem rozvinulo srdeční selhání. Pacienti s těsnou aortální stenózou mohou být vystaveni většímu riziku takové příhody, protože se očekává, že účinek nifedipinu bude pro tyto pacienty méně přínosný kvůli jejich pevné impedanci průtoku přes aortální chlopeň.
OPATŘENÍ
Všeobecné
Hypotenze
Protože nifedipin snižuje periferní vaskulární rezistenci, doporučuje se pečlivé sledování krevního tlaku během počátečního podávání a titrace Adalatu CC. Pečlivé sledování se doporučuje zejména u pacientů, kteří již užívají léky, o kterých je známo, že snižují krevní tlak (viz VAROVÁNÍ ).
Periferní edém
Mírný až střední periferní edém se u přípravku Adalat CC vyskytuje v závislosti na dávce. Míra odečtení placeba je přibližně 8 % při 30 mg, 12 % při 60 mg a 19 % při 90 mg denně. Tento edém je lokalizovaný jev, o kterém se předpokládá, že je spojen s vazodilatací závislých arteriol a malých krevních cév, a nikoli v důsledku dysfunkce levé komory nebo generalizovaného zadržování tekutin. U pacientů, jejichž hypertenze je komplikována městnavým srdečním selháním, je třeba dbát na to, aby se tento periferní edém odlišil od účinků zvyšující se dysfunkce levé komory.
Použití u pacientů s cirhózou
Clearance nifedipinu je snížena a systémová expozice zvýšena u pacientů s cirhózou. Není známo, jak může být změněna systémová expozice u pacientů se středně těžkou nebo těžkou poruchou funkce jater. Může být nezbytné pečlivé sledování a snížení dávky; zvážit zahájení léčby nejnižší dostupnou dávkou.
Laboratorní testy
Bylo zaznamenáno vzácné, obvykle přechodné, ale příležitostně významné zvýšení enzymů, jako je alkalická fosfatáza, CPK, LDH, SGOT a SGPT. Vztah k léčbě nifedipinem je ve většině případů nejistý, ale v některých pravděpodobný. Tyto laboratorní abnormality byly zřídka spojeny s klinickými příznaky; byla však hlášena cholestáza se žloutenkou nebo bez ní. U pacientů léčených přípravkem Adalat 10 mg CC bylo zaznamenáno malé zvýšení (
Nifedipin, stejně jako jiné blokátory kalciových kanálů, snižuje agregaci krevních destiček in vitro. Omezené klinické studie prokázaly mírné, ale statisticky významné snížení agregace krevních destiček a prodloužení doby krvácení u některých pacientů s nifedipinem. Předpokládá se, že je to funkce inhibice transportu vápníku přes membránu krevních destiček. Pro tyto nálezy nebyl prokázán žádný klinický význam.
Byl hlášen pozitivní přímý Coombsův test s hemolytickou anémií nebo bez ní, ale kauzální vztah mezi podáním nifedipinu a pozitivitou tohoto laboratorního testu, včetně hemolýzy, nelze určit.
Ačkoli byl nifedipin bezpečně používán u pacientů s renální dysfunkcí a bylo hlášeno, že má v určitých případech příznivý účinek, u pacientů s již existující chronickou renální insuficiencí bylo hlášeno vzácné reverzibilní zvýšení BUN a sérového kreatininu. Vztah k léčbě nifedipinem je ve většině případů nejistý, ale v některých pravděpodobný.
Karcinogeneze, mutageneze, zhoršení plodnosti
Nifedipin byl podáván perorálně potkanům po dobu dvou let a neprokázalo se, že je karcinogenní. Při podání potkanům před pářením způsobil nifedipin sníženou plodnost v dávce přibližně 30násobku maximální doporučené dávky pro člověka. V literatuře existuje zpráva o reverzibilním snížení schopnosti lidských spermií získaných od omezeného počtu neplodných mužů užívajících doporučené dávky nifedipinu vázat se na vajíčko a oplodnit ho in vitro. Studie mutagenity in vivo byly negativní.
Těhotenství
Kategorie těhotenství C
hlodavců, králíků a opic bylo prokázáno, že nifedipin má různé embryotoxické, placentotoxické, teratogenní a fetotoxické účinky, včetně zakrnělých plodů (krysy, myši a králíci), digitálních anomálií (krysy a králíci), deformací žeber (myši), rozštěp patra (myši), malé placenty a nedostatečně vyvinuté choriové klky (opice), úhyny embryí a plodů (krysy, myši a králíci), prodloužená březost (krysy; nehodnoceno u jiných druhů) a snížené přežití novorozenců (krysy; nehodnoceno v jiné druhy). Na základě mg/kg nebo mg/m² jsou některé dávky spojené s těmito různými účinky vyšší než maximální doporučená dávka pro člověka a některé jsou nižší, ale všechny jsou v řádové velikosti.
Digitální anomálie pozorované u mláďat králíků vystavených nifedipinu jsou nápadně podobné těm, které byly pozorovány u mláďat vystavených fenytoinu, a ty jsou zase podobné deformacím falange, které jsou nejčastější malformací pozorovanou u lidských dětí s in utero expozicí fenytoinu.
Z dostupných klinických důkazů nebylo zjištěno specifické prenatální riziko. Byl však hlášen nárůst perinatální asfyxie, porod císařským řezem, nedonošenost a retardace intrauterinního růstu.
U těhotných žen při podávání nifedipinu v kombinaci se síranem hořečnatým IV musí být pečlivě monitorován krevní tlak kvůli možnosti nadměrného poklesu krevního tlaku, který by mohl poškodit matku a plod.
Neexistují žádné adekvátní a dobře kontrolované studie u těhotných žen.
Kojící matky
Nifedipin se vylučuje do lidského mléka. Kojícím matkám se doporučuje, aby při užívání léku nekojily své děti.
Pediatrické použití
Bezpečnost a účinnost přípravku Adalat 30 mg CC u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Ačkoli malé farmakokinetické studie prokázaly zvýšený poločas a zvýšené Cmax a AUC (viz KLINICKÁ FARMAKOLOGIE : Farmakokinetika a metabolismus ), klinické studie nifedipinu nezahrnovaly dostatečný počet subjektů ve věku 65 a více let, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
Pacienti s intolerancí galaktózy
Protože tento léčivý přípravek obsahuje laktózu, pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným deficitem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
PŘEDÁVKOVAT
Zkušenosti s předávkováním nifedipinem jsou omezené. Příznaky spojené s těžkým předávkováním nifedipinem zahrnují ztrátu vědomí, pokles krevního tlaku, poruchy srdečního rytmu, metabolickou acidózu, hypoxii, kardiogenní šok s plicním edémem. Obecně platí, že předávkování nifedipinem vedoucí k výrazné hypotenzi vyžaduje aktivní kardiovaskulární podporu včetně monitorování kardiovaskulárních a respiračních funkcí, elevace končetin, uvážlivého použití infuze vápníku, presorických látek a tekutin. Po perorálním požití je indikován důkladný výplach žaludku, v případě potřeby v kombinaci s výplachem tenkého střeva. V případech předávkování přípravkem s pomalým uvolňováním, jako je nifedipin, musí být eliminace co nejúplnější, a to i z tenkého střeva, aby se zabránilo následné absorpci léčivé látky. Další tekutina nebo objem musí být podáván s opatrností kvůli riziku přetížení tekutinami.
pacientů s poruchou funkce jater lze očekávat prodloužení clearance nifedipinu. Protože se nifedipin silně váže na proteiny, dialýza pravděpodobně nebude mít žádný přínos; plazmaferéza však může být prospěšná.
Byl hlášen jeden případ masivního předávkování tabletami jiné formulace nifedipinu s prodlouženým uvolňováním. Hlavní účinky požití přibližně 4800 mg nifedipinu u mladého muže pokoušejícího se o sebevraždu v důsledku kokainem navozené deprese byly počáteční závratě, bušení srdce, návaly horka a nervozita. Během několika hodin po požití se rozvinula nevolnost, zvracení a celkový edém. Při prezentaci nebyla patrná žádná významná hypotenze, 18 hodin po požití. Chemické abnormality krve sestávaly z mírného, přechodného zvýšení sérového kreatininu a mírného zvýšení LDH a CPK, ale normální SGOT. Vitální funkce zůstaly stabilní, nebyly zaznamenány žádné elektrokardiografické abnormality a funkce ledvin se vrátila k normálu během 24 až 48 hodin pouze s běžnými podpůrnými opatřeními. Nebyly pozorovány žádné prodloužené následky.
Účinek jednorázového 900mg požití tobolek nifedipinu u pacienta s depresí na angínu na tricyklická antidepresiva byla ztráta vědomí během 30 minut po požití a hluboká hypotenze, která reagovala na infuzi vápníku, presorické látky a náhradu tekutin. U tohoto pacienta byly pozorovány různé abnormality EKG s anamnézou blokády raménka, včetně sinusové bradykardie a různého stupně AV blokády. Ty si vynutily profylaktické umístění dočasného komorového kardiostimulátoru, ale jinak spontánně odezněly. U tohoto pacienta byla zpočátku pozorována významná hyperglykémie, ale hladiny glukózy v plazmě se rychle normalizovaly bez další léčby.
Mladý hypertenzní pacient s pokročilým selháním ledvin požil 280 mg tobolek nifedipinu najednou, s výslednou výraznou hypotenzí reagující na infuzi vápníku a tekutin. Nebyly zaznamenány žádné abnormality AV vedení, arytmie nebo výrazné změny srdeční frekvence, ani nedošlo k žádnému dalšímu zhoršení funkce ledvin.
Bradykardiální poruchy srdečního rytmu lze léčit symptomaticky ß-sympatomimetiky au život ohrožujících bradykardiálních poruch srdečního rytmu lze doporučit dočasnou terapii kardiostimulátorem.
KONTRAINDIKACE
Současné podávání se silnými induktory P450, jako je rifampin, je kontraindikováno, protože účinnost tablet nifedipinu by mohla být významně snížena. (Vidět DROGOVÉ INTERAKCE )
Nifedipin se nesmí používat v případech kardiogenního šoku.
Adalat je kontraindikován u pacientů se známou přecitlivělostí na kteroukoli složku tablety.
KLINICKÁ FARMAKOLOGIE
Nifedipin je inhibitor influxu vápníkových iontů (blokátor pomalého kanálu nebo antagonista vápníkových iontů), který inhibuje transmembránový tok vápníkových iontů do hladkého svalstva cév a srdečního svalu. Kontraktilní procesy hladkého svalstva cév a srdečního svalu jsou závislé na pohybu extracelulárních iontů vápníku do těchto buněk přes specifické iontové kanály. Nifedipin selektivně inhibuje influx iontů vápníku přes buněčnou membránu hladkého svalstva cév a srdečního svalu, aniž by měnil koncentraci vápníku v séru.
Mechanismus působení
Mechanismus, kterým nifedipin snižuje arteriální krevní tlak, zahrnuje periferní arteriální vazodilataci a následně snížení periferní vaskulární rezistence. Zvýšená periferní vaskulární rezistence, základní příčina hypertenze, je výsledkem zvýšení aktivního napětí v hladkém svalstvu cév. Studie prokázaly, že zvýšení aktivního napětí odráží zvýšení cytosolického volného vápníku.
Nifedipin je periferní arteriální vazodilatátor, který působí přímo na hladké svalstvo cév. Vazba nifedipinu na napěťově závislé a pravděpodobně receptorem ovládané kanály v hladkém svalstvu cév vede k inhibici přítoku vápníku těmito kanály. Zásoby intracelulárního vápníku v hladkém svalstvu cév jsou omezené, a proto závisí na přílivu extracelulárního vápníku, aby došlo ke kontrakci. Snížení přítoku vápníku nifedipinem způsobuje arteriální vazodilataci a sníženou periferní vaskulární rezistenci, což vede ke snížení arteriálního krevního tlaku.
Farmakokinetika a metabolismus
Nifedipin je po perorálním podání zcela absorbován. Biologická dostupnost nifedipinu jako Adalat CC ve srovnání s nifedipinem s okamžitým uvolňováním je v rozmezí 84 %-89 %. Po požití tablet Adalat CC nalačno dosahují plazmatické koncentrace vrcholu přibližně za 2,5–5 hodin s druhým malým vrcholem nebo ramenem patrným přibližně 6–12 hodin po dávce. Eliminační poločas nifedipinu podávaného jako Adalat CC je přibližně 7 hodin na rozdíl od známého 2hodinového eliminačního poločasu nifedipinu podávaného jako kapsle s okamžitým uvolňováním.
Když je Adalat CC podáván jako násobky 30 mg tablet v rozmezí dávek 30 mg až 90 mg, je plocha pod křivkou (AUC) úměrná dávce; avšak maximální plazmatická koncentrace pro dávku 90 mg podanou jako 3 x 30 mg je o 29 % vyšší, než se předpokládalo z dávek 30 mg a 60 mg.
Dvě 30mg tablety Adalat CC lze zaměnit za 60mg tabletu Adalat CC. Tři 30mg tablety Adalat CC však vedou k podstatně vyšším hodnotám Cmax než ty po jedné 90mg tabletě Adalat 20mg CC. Tři 30mg tablety by proto neměly být považovány za zaměnitelné s 90mg tabletou.
Dávkování Adalatu CC jednou denně za podmínek nalačno má za následek snížené kolísání plazmatické koncentrace nifedipinu ve srovnání s dávkováním třikrát denně u kapslí nifedipinu s okamžitým uvolňováním. Průměrná maximální plazmatická koncentrace nifedipinu po 90 mg tabletě Adalat 30 mg CC podané nalačno je přibližně 115 ng/ml. Když je Adalat CC podán zdravým dobrovolníkům bezprostředně po jídle s vysokým obsahem tuku, dochází k průměrnému zvýšení maximální plazmatické koncentrace nifedipinu o 60 %, k prodloužení doby do dosažení maximální koncentrace, ale k žádné významné změně AUC. Plazmatické koncentrace nifedipinu, když se Adalat 20 mg CC užívá po tučném jídle, vedou k mírně nižším vrcholům ve srovnání se stejnou denní dávkou formulace s okamžitým uvolňováním podávanou ve třech dílčích dávkách. To může být částečně způsobeno tím, že Adalat CC je méně biologicky dostupný než přípravek s okamžitým uvolňováním.
Nifedipin je rozsáhle metabolizován na vysoce ve vodě rozpustné neaktivní metabolity, které tvoří 60 % až 80 % dávky vyloučené močí. V moči lze detekovat pouze stopy (méně než 0,1 % dávky) nezměněné formy. Zbytek je vylučován stolicí v metabolizované formě, nejpravděpodobněji v důsledku biliární exkrece.
Nifedipin je metabolizován systémem cytochromu P450 3A4. Léky, o kterých je známo, že buď inhibují nebo indukují tento enzymatický systém, mohou změnit první průchod nebo clearance nifedipinu.
Nebyly provedeny žádné studie s Adalatem 30 mg CC u pacientů se selháním ledvin; u pacientů podstupujících hemodialýzu nebo chronickou ambulantní peritoneální dialýzu však nebyly hlášeny významné změny farmakokinetiky tobolek nifedipinu s okamžitým uvolňováním. Vzhledem k tomu, že absorpce nifedipinu z Adalatu CC může být ovlivněna onemocněním ledvin, je třeba při léčbě těchto pacientů postupovat opatrně.
Protože je nifedipin metabolizován systémem cytochromu P450 3A4, jeho farmakokinetika může být u pacientů s chronickým onemocněním jater změněna. Adalat 20 mg CC nebyl studován u pacientů s onemocněním jater; avšak u pacientů s poruchou funkce jater (cirhózou jater) má nifedipin delší poločas eliminace a vyšší biologickou dostupnost než u zdravých dobrovolníků.
Stupeň vazby nifedipinu na proteiny je vysoký (92 %-98 %). Vazba na bílkoviny může být výrazně snížena u pacientů s poruchou funkce ledvin nebo jater.
Po podání Adalatu 30 mg CC zdravým starším mužům a ženám (věk > 60 let) je průměrná Cmax o 36 % vyšší a průměrná plazmatická koncentrace o 70 % vyšší než u mladších pacientů.
zdravých subjektů byl poločas eliminace jiné formulace nifedipinu s prodlouženým uvolňováním delší u starších subjektů (6,7 h) ve srovnání s mladými subjekty (3,8 h) po perorálním podání. Snížená clearance byla také pozorována u starších osob (348 ml/min) ve srovnání s mladými subjekty (519 ml/min) po intravenózním podání.
Současné podávání nifedipinu s grapefruitovou šťávou má za následek až dvojnásobné zvýšení AUC a Cmax v důsledku inhibice metabolismu prvního průchodu v souvislosti s CYP3A. Během užívání nifedipinu je třeba se vyvarovat požití grapefruitu a grapefruitové šťávy.
Klinické studie
Adalat 10 mg CC vyvolal na dávce závislé snížení systolického a diastolického krevního tlaku, jak bylo prokázáno ve dvou dvojitě zaslepených, randomizovaných, placebem kontrolovaných studiích, ve kterých bylo více než 350 pacientů léčeno přípravkem Adalat CC 30, 60 nebo 90 mg jednou denně po dobu 6 týdnů. V první studii byl Adalat 10 mg CC podáván jako monoterapie a ve druhé studii byl Adalat 20 mg CC přidán k betablokátoru u pacientů, kteří nebyli kontrolováni samotným betablokátorem. Průměrné výsledky minimálního krevního tlaku (24 hodin po podání dávky) z těchto studií jsou uvedeny níže:
PRŮMĚRNÉ SNÍŽENÍ KREVNÍHO TLAKU V LEHOTĚ (mmHg) SYSTOLICKÝ/DIASTOLICKÝ
Poměry nejnižší/peak odhadované z 24hodinového monitorování krevního tlaku se pohybovaly od 41 %-78 % pro diastolický a 46 %-91 % pro systolický krevní tlak.
Hemodynamika
Stejně jako jiné blokátory pomalého kanálu má nifedipin negativní inotropní účinek na izolovanou tkáň myokardu. To je zřídka, pokud vůbec, pozorováno u intaktních zvířat nebo lidí, pravděpodobně kvůli reflexním reakcím na jeho vazodilatační účinky. U člověka nifedipin snižuje periferní vaskulární rezistenci, což vede k poklesu systolického a diastolického tlaku, obvykle minimálnímu u normotenzních dobrovolníků (méně než 5-10 mm Hg systolického tlaku), ale někdy většímu. U přípravku Adalat 30mg CC nejsou tyto poklesy krevního tlaku doprovázeny žádnou významnou změnou srdeční frekvence. Hemodynamické studie lékové formy nifedipinu s okamžitým uvolňováním u pacientů s normální komorovou funkcí obecně zjistily malé zvýšení srdečního indexu bez větších účinků na ejekční frakci, enddiastolický tlak levé komory (LVEDP) nebo objem (LVEDV). U pacientů s poruchou funkce komory většina akutních studií prokázala určité zvýšení ejekční frakce a snížení plnícího tlaku levé komory.
Elektrofyziologické účinky
Ačkoli, stejně jako ostatní členové jeho třídy, nifedipin způsobuje mírnou depresi funkce sinoatriálního uzlu a atrioventrikulárního vedení v izolovaných preparátech myokardu, takové účinky nebyly pozorovány ve studiích u intaktních zvířat ani u člověka. Ve formálních elektrofyziologických studiích, převážně u pacientů s normálním převodním systémem, neměl nifedipin podávaný jako tobolka s okamžitým uvolňováním žádnou tendenci prodlužovat atrioventrikulární vedení nebo dobu zotavení sinusového uzlu nebo zpomalovat sinusovou frekvenci.
INFORMACE PRO PACIENTA
Adalat CC je tableta s prodlouženým uvolňováním a měla by se polykat celá a užívat nalačno. Neměl by se podávat s jídlem. Tablety nežvýkejte, nerozdělujte ani nedrťte.
