Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Coreg 25 mg a jak se používá?
Coreg je lék na předpis používaný k léčbě příznaků srdečního selhání a vysokého krevního tlaku (hypertenze). Coreg 25 mg lze užívat samostatně nebo s jinými léky.
Coreg patří do třídy léků nazývaných Beta-blokátory, Alpha Activity.
Není známo, zda je přípravek Coreg 25 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Coreg?
Coreg může způsobit závažné nežádoucí účinky, včetně:
- točení hlavy,
- pomalý nebo nerovnoměrný srdeční tep,
- pocit chladu nebo necitlivosti ve vašich rukou nebo nohou,
- bolest na hrudi,
- suchý kašel,
- sípání,
- tlak na hrudi,
- otok,
- rychlý nárůst hmotnosti,
- pocit dušnosti,
- zvýšená žízeň,
- zvýšené močení,
- sucho v ústech a
- ovocný zápach dechu
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější nežádoucí účinky přípravku Coreg 6,25 mg patří:
- závrať,
- pomalý srdeční tep,
- průjem,
- přibývání na váze,
- suché oči a
- potíže s používáním kontaktních čoček
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Coreg. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
POPIS
Karvedilol je neselektivní β-adrenergní blokátor s α1-blokující aktivitou. Je to (±)-l-(karbazol-4-yloxy)-3-[[2-(o-methoxyfenoxy)ethyl]amino]-2-propanol. Carvedilol je racemická směs s následující strukturou:
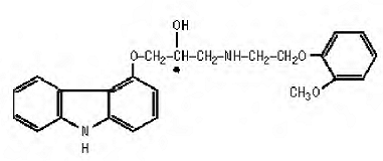
COREG 6,25 mg je bílá, oválná, potahovaná tableta obsahující 3,125 mg, 6,25 mg, 12,5 mg nebo 25 mg karvedilolu. Tablety 6,25 mg, 12,5 mg a 25 mg jsou tablety TILTAB. Neaktivní složky tvoří koloidní oxid křemičitý, krospovidon, hypromelóza, laktóza, magnesium-stearát, polyethylenglykol, polysorbát 80, povidon, sacharóza a oxid titaničitý.
Carvedilol je bílý až téměř bílý prášek s molekulovou hmotností 406,5 a molekulárním vzorcem C24H26N2O4. Je volně rozpustný v dimethylsulfoxidu; rozpustný v methylenchloridu a methanolu; těžce rozpustný v 95% ethanolu a isopropanolu; mírně rozpustný v ethyletheru; a prakticky nerozpustný ve vodě, žaludeční tekutině (simulovaný, TS, pH 1,1) a střevní tekutině (simulovaný, TS bez pankreatinu, pH 7,5).
INDIKACE
Srdeční selhání
COREG je indikován k léčbě mírného až těžkého chronického srdečního selhání ischemického nebo kardiomyopatického původu, obvykle vedle diuretik, ACE inhibitorů a digitalisu, ke zvýšení přežití a také ke snížení rizika hospitalizace [viz DROGOVÉ INTERAKCE , Klinické studie ].
Dysfunkce levé komory po infarktu myokardu
COREG je indikován ke snížení kardiovaskulární mortality u klinicky stabilních pacientů, kteří přežili akutní fázi infarktu myokardu a mají ejekční frakci levé komory menší nebo rovnou 40 % (se symptomatickým srdečním selháním nebo bez něj) [viz Klinické studie ].
Hypertenze
COREG 25 mg je indikován k léčbě esenciální hypertenze [viz Klinické studie ]. Může být použit samostatně nebo v kombinaci s jinými antihypertenzivy, zejména diuretiky thiazidového typu (viz. DROGOVÉ INTERAKCE ].
DÁVKOVÁNÍ A PODÁVÁNÍ
COREG by se měl užívat s jídlem, aby se zpomalila rychlost absorpce a snížil se výskyt ortostatických účinků.
Srdeční selhání
DÁVKOVÁNÍ MUSÍ BĚHEM UP-TITRACE INDIVIDUALIZOVAT A PEČLIVĚ KONTROLOVAT LÉKAŘ. Před zahájením léčby přípravkem COREG 12,5 mg se doporučuje minimalizovat zadržování tekutin. Doporučená počáteční dávka přípravku COREG je 3,125 mg dvakrát denně po dobu 2 týdnů. Pokud je pacient tolerován, může být dávka zvýšena na 6,25, 12,5 a 25 mg dvakrát denně v po sobě jdoucích intervalech alespoň 2 týdnů. Pacienti by měli být udržováni na nižších dávkách, pokud vyšší dávky nejsou tolerovány. Maximální dávka 50 mg dvakrát denně byla podávána pacientům s mírným až středně těžkým srdečním selháním o hmotnosti nad 85 kg (187 liber).
Pacienty je třeba upozornit, že zahájení léčby a (v menší míře) zvýšení dávky může být spojeno s přechodnými příznaky závratě nebo točení hlavy (a vzácně synkopy) během první hodiny po podání dávky. Během těchto období by se pacienti měli vyhýbat situacím, jako je řízení nebo nebezpečné úkoly, kde by příznaky mohly vést ke zranění. Vazodilatační příznaky často nevyžadují léčbu, ale může být užitečné oddělit dobu dávkování COREG 6,25 mg od doby podávání ACE inhibitoru nebo dočasně snížit dávku ACE inhibitoru. Dávka COREG 12,5 mg by se neměla zvyšovat, dokud se příznaky zhoršujícího se srdečního selhání nebo vazodilatace nestabilizují.
Retence tekutin (s nebo bez přechodného zhoršení příznaků srdečního selhání) by měla být léčena zvýšením dávky diuretik.
Dávka COREG by měla být snížena, pokud se u pacientů objeví bradykardie (srdeční frekvence nižší než 55 tepů za minutu).
Epizody závratí nebo retence tekutin během zahájení léčby přípravkem COREG 3,12 mg lze obecně zvládnout bez přerušení léčby a nevylučují následnou úspěšnou titraci karvedilolu nebo příznivou odpověď na karvedilol.
Dysfunkce levé komory po infarktu myokardu
DÁVKOVÁNÍ MUSÍ BÝT INDIVIDUALIZOVÁNO A SLEDOVÁNO BĚHEM UP-TITRACE. Léčba přípravkem COREG může být zahájena hospitalizovaně nebo ambulantně a měla by být zahájena poté, co je pacient hemodynamicky stabilní a retence tekutin byla minimalizována. Doporučuje se zahájit léčbu přípravkem COREG 3,12 mg dávkou 6,25 mg dvakrát denně a po 3 až 10 dnech zvýšit na základě snášenlivosti na 12,5 mg dvakrát denně a poté znovu na cílovou dávku 25 mg dvakrát denně. Může být použita nižší počáteční dávka (3,125 mg dvakrát denně) a/nebo může být rychlost titrace nahoru zpomalena, pokud je to klinicky indikováno (např. kvůli nízkému krevnímu tlaku nebo srdeční frekvenci nebo retenci tekutin). Pacienti by měli být udržováni na nižších dávkách, pokud vyšší dávky nejsou tolerovány. Doporučený dávkovací režim nemusí být měněn u pacientů, kteří byli léčeni IV nebo perorálním β-blokátorem během akutní fáze infarktu myokardu.
Hypertenze
DÁVKOVÁNÍ MUSÍ BÝT INDIVIDUALIZOVÁNO. Doporučená počáteční dávka přípravku COREG 6,25 mg je 6,25 mg dvakrát denně. Pokud je tato dávka tolerována, měla by být dávka udržována po dobu 7 až 14 dnů a poté by měla být v případě potřeby zvýšena na 12,5 mg dvakrát denně, na základě minimálního krevního tlaku, opět za použití stálého systolického tlaku měřeného asi 1 hodinu po podání systolický tlak ve stoje 1 hodinu po podání jako vodítko pro toleranci. Tato dávka by měla být také udržována po dobu 7 až 14 dnů a poté může být upravena až na 25 mg dvakrát denně, pokud je tolerována a potřeba. Plný antihypertenzní účinek přípravku COREG 6,25 mg je patrný během 7 až 14 dnů. Celková denní dávka by neměla překročit 50 mg.
Při současném podávání s diuretiky lze očekávat aditivní účinky a zveličení ortostatické složky účinku karvedilolu.
Poškození jater
COREG 25 mg by neměl být podáván pacientům s těžkou poruchou funkce jater (viz KONTRAINDIKACE ].
JAK DODÁVÁNO
Dávkování A Síly
Bílé, oválné, potahované tablety jsou dostupné v následujících silách:
- 3,125 mg – s vyrytým „39“ a „SB“
- 6,25 mg – s vyrytým „4140“ a „SB“
- 12,5 mg – s vyrytým „4141“ a „SB“
- 25 mg – s vyrytým „4142“ a „SB“
Skladování A Manipulace
Bílé, oválné, potahované tablety jsou dostupné v následujících silách:
- 3,125 mg – s vyrytým „39“ a „SB“
- 6,25 mg – s vyrytým „4140“ a „SB“
- 12,5 mg – s vyrytým „4141“ a „SB“
- 25 mg – s vyrytým „4142“ a „SB“
Tablety 6,25 mg, 12,5 mg a 25 mg jsou tablety TILTAB.
- 3,125 mg lahvičky po 100: NDC 0007-4139-20
- 6,25 mg lahvičky po 100: NDC 0007-4140-20
- 12,5 mg lahvičky po 100: NDC 0007-4141-20
- 25 mg lahvičky po 100: NDC 0007-4142-20
Uchovávejte při teplotě do 30°C (86°F). Chraňte před vlhkostí. Dávkujte v těsné nádobě odolné vůči světlu.
Vyrobeno pro: GlaxoSmithKline Research Triangle Park, NC 27709. Revize: září 2017.
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Bezpečnost COREG 25 mg byla hodnocena u subjektů se srdečním selháním (mírné, středně těžké a těžké), u subjektů s dysfunkcí levé komory po infarktu myokardu au subjektů s hypertenzí. Pozorovaný profil nežádoucích účinků byl v souladu s farmakologií léku a zdravotním stavem subjektů v klinických studiích. Nežádoucí účinky hlášené pro každou z těchto populací pacientů jsou uvedeny níže. Vyloučeny jsou nežádoucí příhody považované za příliš obecné na to, aby byly informativní, a ty, které nejsou přiměřeně spojeny s užíváním léku, protože byly spojeny s léčeným stavem nebo jsou v léčené populaci velmi časté. Četnost nežádoucích příhod byla obecně podobná napříč demografickými podskupinami (muži a ženy, starší lidé a starší lidé, černoši a nečerní).
Srdeční selhání
COREG 12,5 mg byl hodnocen z hlediska bezpečnosti při srdečním selhání u více než 4 500 subjektů po celém světě, z nichž více než 2 100 se zúčastnilo placebem kontrolovaných klinických studií. Přibližně 60 % celkové léčené populace v placebem kontrolovaných klinických studiích dostávalo COREG 3,12 mg po dobu alespoň 6 měsíců a 30 % dostávalo COREG po dobu alespoň 12 měsíců. Ve studii COMET bylo 1 511 subjektů s mírným až středně těžkým srdečním selháním léčeno přípravkem COREG po dobu až 5,9 let (průměr: 4,8 let). Jak v amerických klinických studiích u mírného až středně těžkého srdečního selhání, které porovnávaly COREG 3,12 mg v denních dávkách do 100 mg (n = 765) s placebem (n = 437), tak v mezinárodní klinické studii u těžkého srdečního selhání (COPERNICUS ), která porovnávala COREG v denních dávkách do 50 mg (n = 1 156) s placebem (n = 1 133), četnost přerušení léčby z důvodu nežádoucích účinků byla podobná u subjektů s karvedilolem a placebem. V placebem kontrolovaných klinických studiích byly jedinou příčinou přerušení léčby větším než 1 % a vyskytujícím se častěji u karvedilolu závratě (1,3 % u karvedilolu, 0,6 % u placeba ve studii COPERNICUS).
Tabulka 1 ukazuje nežádoucí příhody hlášené u subjektů s mírným až středně těžkým srdečním selháním zařazeným do placebem kontrolovaných klinických studií v USA a se závažným srdečním selháním zařazeným do studie COPERNICUS. Jsou uvedeny nežádoucí účinky, které se vyskytovaly častěji u subjektů léčených léčivem než u subjektů léčených placebem s incidencí vyšší než 3 % u subjektů léčených karvedilolem bez ohledu na kauzalitu. Medián zkušební medikace byl 6,3 měsíce u subjektů s karvedilolem i placebem ve studiích s mírným až středně závažným srdečním selháním a 10,4 měsíce ve studii u subjektů se závažným srdečním selháním. Profil nežádoucích účinků COREG 3,12 mg pozorovaný v dlouhodobé studii COMET byl obecně podobný profilu pozorovanému ve studiích se srdečním selháním v USA.
V těchto studiích bylo také hlášeno srdeční selhání a dušnost, ale četnost byla stejná nebo vyšší u subjektů, které dostávaly placebo.
Následující nežádoucí příhody byly hlášeny s frekvencí vyšší než 1 %, ale nižší než nebo rovnou 3 % a častěji s COREG 3,12 mg buď v placebem kontrolovaných studiích v USA u subjektů s mírným až středně těžkým srdečním selháním nebo u subjektů se závažným srdečním selháním ve studii COPERNICUS.
Výskyt větší než 1 % až menší nebo rovný 3 %
Tělo jako celek: Alergie, malátnost, hypovolémie, horečka, edém nohou.
Kardiovaskulární: Přetížení tekutin, posturální hypotenze, zhoršená angina pectoris, AV blokáda, palpitace, hypertenze.
Centrální a periferní nervový systém: Hypestezie, vertigo, parestézie.
Gastrointestinální: Melena, paradentóza.
Játra a žlučový systém: Zvýšil se SGPT, zvýšil se SGOT.
Metabolické a nutriční: Hyperurikémie, hypoglykémie, hyponatrémie, zvýšená alkalická fosfatáza, glykosurie, hypervolémie, diabetes mellitus, zvýšení GGT, ztráta hmotnosti, hyperkalémie, zvýšení kreatininu.
Muskuloskeletální: Svalové křeče.
Krvácení, krevní destičky a srážlivost: Snížený protrombin, purpura, trombocytopenie.
psychiatrické: Spavost.
Reprodukční, samec: Impotence.
Speciální smysly: Rozmazané vidění.
Močový systém: Renální insuficience, albuminurie, hematurie.
Dysfunkce levé komory po infarktu myokardu
COREG byl hodnocen z hlediska bezpečnosti u pacientů, kteří přežili akutní infarkt myokardu s dysfunkcí levé komory, ve studii CAPRICORN, která zahrnovala 969 subjektů, které dostávaly COREG 6,25 mg, a 980 pacientů, kteří dostávali placebo. Přibližně 75 % subjektů dostávalo COREG 25 mg po dobu alespoň 6 měsíců a 53 % dostávalo COREG 12,5 mg po dobu alespoň 12 měsíců. Subjekty byly léčeny v průměru 12,9 měsíce a 12,8 měsíce přípravkem COREG 12,5 mg a placebem, v daném pořadí.
Nejčastější nežádoucí účinky hlášené u COREG 25 mg ve studii CAPRICORN byly v souladu s profilem léku ve studiích srdečního selhání v USA a ve studii COPERNICUS. Jedinými dalšími nežádoucími účinky hlášenými u KAZOROŽA u více než 3 % subjektů a častěji u karvedilolu byla dušnost, anémie a plicní edém. Následující nežádoucí příhody byly hlášeny s frekvencí vyšší než 1 %, ale nižší nebo rovnou 3 % a častěji u COREG: chřipkový syndrom, cerebrovaskulární příhoda, porucha periferních cév, hypotonie, deprese, gastrointestinální bolest, artritida a dna. Celková míra přerušení léčby z důvodu nežádoucích účinků byla podobná v obou skupinách subjektů. V této databázi byla jedinou příčinou přerušení léčby větším než 1 % a vyskytujícím se častěji u karvedilolu hypotenze (1,5 % u karvedilolu, 0,2 % u placeba).
Hypertenze
COREG byl hodnocen z hlediska bezpečnosti u hypertenze u více než 2 193 subjektů v klinických studiích v USA a u 2 976 subjektů v mezinárodních klinických studiích. Přibližně 36 % z celkové léčené populace dostávalo COREG po dobu alespoň 6 měsíců. Většina nežádoucích účinků hlášených během léčby přípravkem COREG 25 mg byla mírné až střední závažnosti. V kontrolovaných klinických studiích v USA přímo porovnávajících COREG 12,5 mg v dávkách do 50 mg (n = 1 142) s placebem (n = 462), 4,9 % subjektů užívajících COREG 6,25 mg přerušilo léčbu pro nežádoucí účinky oproti 5,2 % subjektů s placebem. Ačkoli nebyl celkový rozdíl v četnosti přerušení léčby, přerušení byla častější ve skupině s karvedilolem pro posturální hypotenzi (1 % oproti 0). Celkový výskyt nežádoucích účinků v placebem kontrolovaných studiích v USA se zvyšoval se zvyšující se dávkou COREG. U jednotlivých nežádoucích účinků to bylo možné rozlišit pouze na závratě, jejichž frekvence se zvýšila z 2 % na 5 %, když se celková denní dávka zvýšila z 6,25 mg na 50 mg.
Tabulka 2 ukazuje nežádoucí příhody v placebem kontrolovaných klinických studiích v USA pro hypertenzi, které se vyskytly s incidencí vyšší nebo rovnou 1 % bez ohledu na kauzalitu a které byly častější u subjektů léčených léky než u subjektů léčených placebem.
V těchto studiích byla také hlášena dušnost a únava, ale četnost byla stejná nebo vyšší u subjektů, které dostávaly placebo.
Následující nežádoucí účinky nepopsané výše byly hlášeny jako možná nebo pravděpodobně související s COREG 25 mg v celosvětových otevřených nebo kontrolovaných studiích s COREG 12,5 mg u subjektů s hypertenzí nebo srdečním selháním.
Incidence větší než 0,1 % až menší nebo rovna 1 %
Kardiovaskulární: Periferní ischemie, tachykardie.
Centrální a periferní nervový systém m: Hypokineze.
Gastrointestinální: Bilirubinémie, zvýšené jaterní enzymy (0,2 % pacientů s hypertenzí a 0,4 % pacientů se srdečním selháním bylo přerušeno z důvodu zvýšení jaterních enzymů) (viz Postmarketingové zkušenosti ].
psychiatrické: Nervozita, poruchy spánku, zhoršená deprese, porucha koncentrace, abnormální myšlení, paronirie, emoční labilita.
Dýchací systém: Astma [viz KONTRAINDIKACE ].
Reprodukční, samec: Snížené libido.
Kůže a přílohy: Pruritus, erytematózní vyrážka, makulopapulární vyrážka, psoriaformní vyrážka, fotosenzitivní reakce.
Speciální smysly: Tinnitus.
Močový systém: Frekvence mikce se zvýšila.
Autonomní nervový systém: Sucho v ústech, zvýšené pocení.
Metabolické a nutriční: Hypokalémie, hypertriglyceridémie.
Hematologické: Anémie, leukopenie.
Následující příhody byly hlášeny u méně než nebo rovny 0,1 % subjektů a jsou potenciálně důležité: kompletní AV blokáda, blokáda raménka, ischemie myokardu, cerebrovaskulární porucha, křeče, migréna, neuralgie, paréza, anafylaktoidní reakce, alopecie, exfoliativní dermatitida, amnézie, GI krvácení, bronchospasmus, plicní edém, snížený sluch, respirační alkalóza, zvýšený BUN, snížený HDL, pancytopenie a atypické lymfocyty.
Laboratorní abnormality
Během léčby přípravkem COREG bylo pozorováno reverzibilní zvýšení sérových transamináz (ALT nebo AST). Míry zvýšení transamináz (2 až 3násobek horní hranice normálu) pozorované během kontrolovaných klinických studií byly obecně podobné mezi subjekty léčenými přípravkem COREG a subjekty léčenými placebem. U COREG však bylo pozorováno zvýšení transamináz, potvrzené opětovným podáním. V dlouhodobé, placebem kontrolované studii u těžkého srdečního selhání měli jedinci léčení přípravkem COREG 25 mg nižší hodnoty jaterních transamináz než jedinci léčení placebem, pravděpodobně proto, že zlepšení srdeční funkce vyvolané přípravkem COREG 6,25 mg vedlo k menšímu přetížení jater a/ nebo zlepšený průtok krve játry.
COREG 25 mg nebyl spojen s klinicky významnými změnami sérového draslíku, celkových triglyceridů, celkového cholesterolu, HDL cholesterolu, kyseliny močové, dusíku močoviny v krvi nebo kreatininu. U hypertenzních pacientů nebyly zaznamenány žádné klinicky významné změny v sérové glykémii nalačno; sérová glukóza nalačno nebyla v klinických studiích se srdečním selháním hodnocena.
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání COREG po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Poruchy krve a lymfatického systému
Aplastická anémie.
Poruchy imunitního systému
Hypersenzitivita (např. anafylaktické reakce, angioedém, kopřivka).
Poruchy ledvin a močových cest
Únik moči.
Respirační, hrudní a mediastinální poruchy
Intersticiální pneumonitida.
Poruchy kůže a podkožní tkáně
Stevens-Johnsonův syndrom, toxická epidermální nekrolýza, erythema multiforme.
DROGOVÉ INTERAKCE
Inhibitory CYP2D6 a špatné metabolizátory
Interakce karvedilolu se silnými inhibitory izoenzymu CYP2D6 (jako je chinidin, fluoxetin, paroxetin a propafenon) nebyly studovány, ale lze očekávat, že tyto léky zvýší hladiny R(+) enantiomeru karvedilolu v krvi [viz KLINICKÁ FARMAKOLOGIE ]. Retrospektivní analýza vedlejších účinků v klinických studiích ukázala, že slabí metabolizátoři 2D6 měli vyšší míru závratí během titrace směrem nahoru, pravděpodobně v důsledku vazodilatačních účinků vyšších koncentrací α-blokujícího R(+) enantiomeru.
Hypotenzní činidla
Pacienti užívající β-blokátory a léky, které mohou depleci katecholaminů (např. reserpin a inhibitory monoaminooxidázy), by měli být pečlivě sledováni, zda se u nich nevyskytují známky hypotenze a/nebo závažné bradykardie.
Současné podávání klonidinu s β-blokátorem může způsobit hypotenzi a bradykardii. Pokud má být ukončena současná léčba β-blokátorem a klonidinem, měl by být β-blokátor vysazen jako první. Léčba klonidinem může být poté o několik dní později přerušena postupným snižováním dávky.
Cyklosporin
Mírné zvýšení průměrných minimálních koncentrací cyklosporinu bylo pozorováno po zahájení léčby karvedilolem u 21 pacientů po transplantaci ledvin, kteří trpěli chronickou vaskulární rejekcí. Přibližně u 30 % subjektů musela být dávka cyklosporinu snížena, aby se koncentrace cyklosporinu udržely v terapeutickém rozmezí, zatímco u zbytku nebyla nutná žádná úprava. V průměru pro skupinu byla dávka cyklosporinu u těchto subjektů snížena asi o 20 %. Vzhledem k široké interindividuální variabilitě potřebné úpravy dávky se doporučuje po zahájení léčby karvedilolem pečlivě sledovat koncentrace cyklosporinu a podle potřeby upravit dávku cyklosporinu.
Digitalisové glykosidy
Jak digitalisové glykosidy, tak β-blokátory zpomalují atrioventrikulární vedení a snižují srdeční frekvenci. Současné užívání může zvýšit riziko bradykardie. Při současném podávání digoxinu a karvedilolu se koncentrace digoxinu zvýší asi o 15 %. Proto se doporučuje zvýšené monitorování digoxinu při zahájení, úpravě nebo vysazení COREG [viz KLINICKÁ FARMAKOLOGIE ].
Induktory/inhibitory jaterního metabolismu
Rifampin snížil plazmatické koncentrace karvedilolu asi o 70 % [viz KLINICKÁ FARMAKOLOGIE ]. Cimetidin zvýšil AUC asi o 30 %, ale nezpůsobil žádnou změnu Cmax [viz KLINICKÁ FARMAKOLOGIE ].
Amiodaron
Amiodaron a jeho metabolit desethyl amiodaron, inhibitory CYP2C9 a P-glykoprotein zvýšily koncentrace S(-)-enantiomeru karvedilolu nejméně dvojnásobně [viz KLINICKÁ FARMAKOLOGIE ]. Současné podávání amiodaronu nebo jiných inhibitorů CYP2C9, jako je flukonazol, s COREG může zvýšit β-blokující aktivitu, což má za následek další zpomalení srdeční frekvence nebo srdečního vedení. Pacienti by měli být sledováni, zda se u nich nevyskytují známky bradykardie nebo srdečního bloku, zvláště pokud je jedna látka přidána k již existující léčbě s druhou.
Blokátory vápníkových kanálů
Při současném podávání COREG 25 mg s diltiazemem byla pozorována porucha vedení (vzácně s hemodynamickým kompromisem). Stejně jako u jiných β-blokátorů, pokud je COREG 25 mg podáván s blokátory kalciových kanálů typu verapamil nebo diltiazem, doporučuje se monitorovat EKG a krevní tlak.
Inzulín nebo perorální hypoglykemie
β-blokátory mohou zvýšit účinek inzulínu a perorálních hypoglykemik na snížení hladiny cukru v krvi. Proto se u pacientů užívajících inzulín nebo perorální hypoglykemika doporučuje pravidelné sledování hladiny glukózy v krvi [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Anestézie
Pokud má léčba COREG pokračovat peroperačně, je třeba věnovat zvláštní pozornost použití anestetik, která tlumí funkci myokardu, jako je éter, cyklopropan a trichlorethylen [viz PŘEDÁVKOVAT ].
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Ukončení Terapie
Pacienti s onemocněním koronárních tepen, kteří jsou léčeni přípravkem COREG, by měli být upozorněni na náhlé přerušení léčby. U pacientů s anginou pectoris byly po náhlém přerušení léčby β-blokátory hlášeny závažné exacerbace anginy pectoris a výskyt infarktu myokardu a ventrikulárních arytmií. Poslední 2 komplikace se mohou objevit s předchozí exacerbací anginy pectoris nebo bez ní. Stejně jako u jiných β-blokátorů by při plánovaném vysazení COREG měli být pacienti pečlivě sledováni a doporučeni, aby omezili fyzickou aktivitu na minimum. COREG by měl být přerušen během 1 až 2 týdnů, kdykoli je to možné. Pokud se angina pectoris zhorší nebo se rozvine akutní koronární insuficience, doporučuje se urychleně, alespoň dočasně, COREG znovu nasadit. Vzhledem k tomu, že onemocnění koronárních tepen je časté a nemusí být rozpoznáno, může být rozumné neukončit léčbu přípravkem COREG 3,12 mg náhle ani u pacientů léčených pouze pro hypertenzi nebo srdeční selhání.
Bradykardie
klinických studiích způsobil COREG 25 mg bradykardii asi u 2 % pacientů s hypertenzí, 9 % pacientů se srdečním selháním a 6,5 % pacientů s infarktem myokardu a dysfunkcí levé komory. Pokud tepová frekvence klesne pod 55 tepů za minutu, je třeba snížit dávku.
Hypotenze
klinických studiích primárně mírného až středně těžkého srdečního selhání se hypotenze a posturální hypotenze vyskytly u 9,7 % a synkopa u 3,4 % subjektů užívajících COREG ve srovnání s 3,6 % a 2,5 % subjektů užívajících placebo. Riziko těchto příhod bylo nejvyšší během prvních 30 dnů podávání, což odpovídalo období titrace nahoru a bylo důvodem k přerušení léčby u 0,7 % subjektů užívajících COREG 12,5 mg ve srovnání s 0,4 % subjektů s placebem. V dlouhodobé, placebem kontrolované studii u těžkého srdečního selhání (COPERNICUS) se hypotenze a posturální hypotenze vyskytly u 15,1 % a synkopa u 2,9 % subjektů se srdečním selháním užívajících COREG ve srovnání s 8,7 % a 2,3 % subjektů s placebem, v tomto pořadí. Tyto příhody byly příčinou přerušení terapie u 1,1 % subjektů užívajících COREG, ve srovnání s 0,8 % subjektů užívajících placebo.
Posturální hypotenze se vyskytla u 1,8 % a synkopa u 0,1 % pacientů s hypertenzí, primárně po úvodní dávce nebo v době zvýšení dávky a byla důvodem k přerušení léčby u 1 % pacientů.
Ve studii CAPRICORN u pacientů, kteří přežili akutní infarkt myokardu, se hypotenze nebo posturální hypotenze objevila u 20,2 % subjektů užívajících COREG ve srovnání s 12,6 % subjektů užívajících placebo. Synkopa byla hlášena u 3,9 % a 1,9 % subjektů. Tyto příhody byly příčinou přerušení terapie u 2,5 % subjektů užívajících COREG, ve srovnání s 0,2 % subjektů užívajících placebo.
Počínaje nízkou dávkou, podáváním s jídlem a postupnou titrací směrem nahoru by se měla snížit pravděpodobnost synkopy nebo nadměrné hypotenze (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Během zahájení léčby by měl být pacient varován, aby se vyhnul situacím, jako je řízení nebo nebezpečné úkoly, kdy by mohlo dojít ke zranění v případě synkopy.
Srdeční selhání/zadržování tekutin
Během titrace karvedilolu nahoru se může objevit zhoršení srdečního selhání nebo retence tekutin. Pokud se takové příznaky objeví, diuretika by měla být zvýšena a dávka karvedilolu by se neměla zvyšovat, dokud se neobnoví klinická stabilita (viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Příležitostně je nutné snížit dávku karvedilolu nebo jej dočasně vysadit. Takové epizody nevylučují následnou úspěšnou titraci nebo příznivou reakci na karvedilol. V placebem kontrolované studii u subjektů se závažným srdečním selháním bylo zhoršení srdečního selhání během prvních 3 měsíců hlášeno v podobné míře u karvedilolu au placeba. Pokud léčba trvala déle než 3 měsíce, bylo zhoršení srdečního selhání hlášeno méně často u subjektů léčených karvedilolem než u pacientů užívajících placebo. Zhoršení srdečního selhání pozorované během dlouhodobé léčby s větší pravděpodobností souvisí se základním onemocněním pacienta než s léčbou karvedilolem.
Nealergický bronchospasmus
Pacienti s bronchospastickým onemocněním (např. chronická bronchitida, emfyzém) by obecně neměli dostávat β-blokátory. COREG lze používat s opatrností u pacientů, kteří nereagují na jiná antihypertenziva nebo je nemohou tolerovat. Při použití COREG je rozumné použít nejmenší účinnou dávku, aby se minimalizovala inhibice endogenních nebo exogenních β-agonistů.
Do klinických studií u pacientů se srdečním selháním byli zařazeni jedinci s bronchospastickým onemocněním, pokud nepotřebovali perorální nebo inhalační medikaci k léčbě jejich bronchospastického onemocnění. U těchto pacientů se doporučuje používat karvedilol s opatrností. Doporučené dávkování by mělo být pečlivě dodržováno a dávka by měla být snížena, pokud jsou během titrace nahoru pozorovány známky bronchospasmu.
Kontrola glykémie u diabetu 2. typu
Obecně platí, že β-blokátory mohou maskovat některé projevy hypoglykémie, zejména tachykardii. Neselektivní β-blokátory mohou zesílit hypoglykémii vyvolanou inzulínem a zpomalit obnovení hladin glukózy v séru. Pacienti se spontánní hypoglykémií nebo diabetici užívající inzulín nebo perorální hypoglykemická činidla by měli být na tyto možnosti upozorněni.
U pacientů se srdečním selháním a diabetem může léčba karvedilolem vést ke zhoršení hyperglykémie, která reaguje na zintenzivnění hypoglykemické terapie. Při zahájení, úpravě nebo vysazení karvedilolu se doporučuje monitorovat glykémii. Studie určené ke zkoumání účinků karvedilolu na kontrolu glykémie u pacientů s diabetem a srdečním selháním nebyly provedeny.
Ve studii zaměřené na zkoumání účinků karvedilolu na glykemickou kontrolu u populace s mírnou až středně těžkou hypertenzí a dobře kontrolovaným diabetes mellitus 2. typu neměl karvedilol na základě měření HbA1c žádný nepříznivý účinek na glykemickou kontrolu [viz Klinické studie ].
Periferní vaskulární onemocnění
β-blokátory mohou u pacientů s onemocněním periferních cév urychlit nebo zhoršit příznaky arteriální insuficience. U takových jedinců je třeba postupovat opatrně.
Zhoršení funkce ledvin
Vzácně vedlo použití karvedilolu u pacientů se srdečním selháním ke zhoršení funkce ledvin. Zdá se, že rizikovými pacienty jsou pacienti s nízkým krevním tlakem (systolický krevní tlak nižší než 100 mm Hg), ischemickou chorobou srdeční a difuzním vaskulárním onemocněním a/nebo základní renální insuficiencí. Po vysazení karvedilolu se funkce ledvin vrátila na výchozí hodnotu. U pacientů s těmito rizikovými faktory se doporučuje monitorovat renální funkce během titrace karvedilolu nahoru a vysadit lék nebo snížit dávkování, pokud dojde ke zhoršení renálních funkcí.
Velká chirurgie
Chronicky podávaná léčba β-blokátory by neměla být rutinně vysazována před velkým chirurgickým zákrokem; avšak zhoršená schopnost srdce reagovat na reflexní adrenergní stimuly může zvýšit rizika celkové anestezie a chirurgických zákroků.
Tyreotoxikóza
β-adrenergní blokáda může maskovat klinické příznaky hypertyreózy, jako je tachykardie. Náhlé vysazení β-blokády může být následováno exacerbací příznaků hypertyreózy nebo může vyvolat bouři štítné žlázy.
Feochromocytom
U pacientů s feochromocytomem by měla být léčba α-blokátorem zahájena před použitím jakéhokoli β-blokátoru. Přestože karvedilol má jak α-, tak β-blokující farmakologické účinky, nejsou žádné zkušenosti s jeho použitím u tohoto stavu. Proto je třeba opatrnosti při podávání karvedilolu pacientům s podezřením na feochromocytom.
Prinzmetalova varianta anginy pectoris
Látky s neselektivní β-blokující aktivitou mohou vyvolat bolest na hrudi u pacientů s Prinzmetalovou variantou anginy pectoris. U těchto pacientů nejsou žádné klinické zkušenosti s karvedilolem, ačkoli α-blokující aktivita může takovým příznakům zabránit. Při podávání karvedilolu pacientům s podezřením na Prinzmetalovu variantu anginy pectoris je však třeba postupovat opatrně.
Riziko Anafylaktické Reakce
Při užívání β-blokátorů mohou být pacienti s anamnézou těžké anafylaktické reakce na různé alergeny reaktivnější na opakovanou expozici, ať už náhodnou, diagnostickou nebo terapeutickou. Takoví pacienti nemusí reagovat na obvyklé dávky adrenalinu používané k léčbě alergické reakce.
Intraoperační syndrom plovoucí duhovky
Intraoperační syndrom plovoucí duhovky (IFIS) byl pozorován během operace katarakty u některých pacientů léčených alfa-1 blokátory (COREG je alfa/beta blokátor). Tato varianta syndromu malé zornice je charakterizována kombinací ochablé duhovky, která se vlní v reakci na intraoperační irigační proudy, progresivní intraoperační miózou navzdory předoperační dilataci standardními mydriatickými léky a potenciálním prolapsem duhovky směrem k fakoemulzifikačním řezům. Oftalmolog pacienta by měl být připraven na možné úpravy chirurgické techniky, jako je použití háčků duhovky, kroužků dilatátoru duhovky nebo viskoelastických látek. Nezdá se, že by ukončení léčby alfa-1 blokátory před operací katarakty mělo přínos.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Pacienti užívající COREG by měli být upozorněni na následující:
- Pacienti by měli užívat COREG s jídlem.
- Pacienti by neměli přerušovat nebo přerušovat užívání přípravku COREG 25 mg bez rady lékaře.
- Pacienti se srdečním selháním by se měli poradit se svým lékařem, pokud zaznamenají známky nebo příznaky zhoršujícího se srdečního selhání, jako je zvýšení tělesné hmotnosti nebo rostoucí dušnost.
- Pacienti mohou zaznamenat pokles krevního tlaku ve stoje, což má za následek závratě a vzácně mdloby. Pokud se tyto příznaky sníženého krevního tlaku objeví, pacienti by si měli sednout nebo lehnout.
- Pokud se u pacientů objeví závratě nebo únava, měli by se vyvarovat řízení nebo nebezpečných činností.
- Pacienti by se měli poradit s lékařem, pokud pociťují závratě nebo mdloby, v případě, že je třeba upravit dávkování.
- Diabetičtí pacienti by měli hlásit jakékoli změny hladiny cukru v krvi svému lékaři.
- U nositelů kontaktních čoček může dojít ke snížení slzení.
COREG 25 mg, COREG 3,12 mg CR a TILTAB jsou ochranné známky vlastněné nebo licencované skupinou společností GSK.
Další uvedená značka je ochranná známka vlastněná nebo licencovaná jejím vlastníkem a není vlastněna ani licencována skupinou společností GSK. Výrobce této značky není spojen se skupinou společností GSK ani její produkty a nepodporuje je.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Ve dvouletých studiích prováděných na potkanech, kterým byl podáván karvedilol v dávkách až 75 mg na kg za den (12násobek MRHD v mg/m2) nebo u myší, kterým bylo podáváno až 200 mg/kg/den (16násobek MRHD v mg/m2). m2), karvedilol neměl žádný karcinogenní účinek.
Karvedilol byl negativní, když byl testován v sérii testů genotoxicity, včetně testů Ames a CHO/HGPRT na mutagenitu a in vitro křeččích mikronukleů a in vivo testů na klastogenitu lidských lymfocytů.
kombinované studii fertility/vývojové/postnatální toxicity byl potkanům podáván karvedilol (12, 60, 300 mg na kg za den) orálně sondou po dobu 2 týdnů před pářením a během páření, březosti a odstavu u samic a 62 let. dny před pářením a během páření u samců. V dávce 300 mg na kg za den (více než nebo rovné 50násobku MRHD v mg na m2) byl karvedilol toxický pro dospělé potkany (sedace, snížený přírůstek hmotnosti) a byl spojen se sníženým počtem úspěšných páření, prodlouženým doba páření, méně žlutých tělísek a implantátů na matku, méně živých mláďat na vrh a zpoždění ve fyzickém růstu/vývoji. Hladina bez účinku pro zjevnou toxicitu a poškození plodnosti byla 60 mg na kg za den (10násobek MRHD v mg na m2).
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
Dostupné údaje týkající se použití COREG 12,5 mg u těhotných žen nejsou dostatečné k tomu, aby bylo možné určit, zda existují rizika nepříznivých vývojových výsledků spojená s užíváním léků. Existují rizika pro matku a plod spojená se špatně kontrolovanou hypertenzí v těhotenství. Užívání beta-blokátorů během třetího trimestru těhotenství může zvýšit riziko hypotenze, bradykardie, hypoglykémie a respirační deprese u novorozenců. viz Klinické úvahy ]. V reprodukčních studiích na zvířatech nebyly žádné důkazy o nepříznivých vývojových výsledcích při klinicky relevantních dávkách [ viz Data ]. Perorální podávání karvedilolu březím krysám během organogeneze vedlo k postimplantační ztrátě, snížení tělesné hmotnosti plodu a zvýšené frekvenci opožděného vývoje skeletu plodu při dávkách toxických pro matku, které byly 50krát vyšší než maximální doporučená dávka pro člověka (MRHD). Navíc perorální podávání karvedilolu březím králíkům během organogeneze vedlo ke zvýšeným postimplantačním ztrátám v dávkách 25krát vyšších, než je MRHD. viz Data ].
Odhadované základní riziko závažných vrozených vad a potratu pro uvedené populace není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.

Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s onemocněním
Hypertenze v těhotenství zvyšuje u matky riziko preeklampsie, gestačního diabetu, předčasného porodu a porodních komplikací (např. nutnost císařského řezu a poporodní krvácení). Hypertenze zvyšuje riziko fetálního omezení intrauterinního růstu a intrauterinní smrti. Těhotné ženy s hypertenzí by měly být pečlivě sledovány a odpovídajícím způsobem léčeny.
Fetální/neonatální nežádoucí reakce
Novorozenci žen s hypertenzí, kteří jsou léčeni betablokátory během třetího trimestru těhotenství, mohou mít zvýšené riziko hypotenze, bradykardie, hypoglykémie a respirační deprese. Sledujte u novorozenců příznaky hypotenze, bradykardie, hypoglykémie a respirační deprese a podle toho se řiďte.
Data
Údaje o zvířatech
Studie provedené na potkanech a králících, kterým byl během organogeneze plodu podáván karvedilol, odhalily zvýšenou postimplantační ztrátu u potkanů v dávce toxické pro matku 300 mg na kg za den (50násobek MRHD v mg na m2) au králíků (bez přítomnosti matky toxicita) v dávkách 75 mg na kg za den (25násobek MRHD v mg na m2). U potkanů také došlo ke snížení tělesné hmotnosti plodu při dávce 300 mg na kg za den (50krát vyšší než MRHD v mg na m2) doprovázené zvýšeným výskytem plodů s opožděným vývojem kostry. U potkanů byla hladina bez účinku pro embryofetální toxicitu 60 mg na kg za den (10násobek MRHD v mg na m2); u králíků to bylo 15 mg na kg za den (5násobek MRHD v mg na m2). Ve studii prenatálního a postnatálního vývoje u potkanů, kterým byl podáván karvedilol od pozdní březosti až do laktace, byla pozorována zvýšená embryoletalita při dávce toxické pro matku 200 mg na kg za den (přibližně 32násobek MRHD v mg na m2). a úmrtnost mláďat a opoždění fyzického růstu/vývoje byly pozorovány při dávce 60 mg na kg za den (10násobek MRHD v mg na m2) bez mateřské toxicity. Hladina bez účinku byla 12 mg na kg za den (dvojnásobek MRHD v mg na m2). Karvedilol byl přítomen ve tkáni plodu potkana.
Laktace
Shrnutí rizik
Neexistují žádné údaje o přítomnosti karvedilolu v mateřském mléce, o účincích na kojené dítě nebo o účincích na produkci mléka. Karvedilol je přítomen v mléce kojících potkanů. Vývojové a zdravotní přínosy kojení by měly být zváženy společně s klinickou potřebou matky COREG a veškerými potenciálními nežádoucími účinky na kojené dítě z COREG 3,12 mg nebo ze základního stavu matky.
Pediatrické použití
Účinnost COREG 3,12 mg u pacientů mladších 18 let nebyla stanovena.
Ve dvojitě zaslepené studii bylo 161 dětí (průměrný věk: 6 let; rozmezí: 2 měsíce až 17 let; 45 % mladších než 2 roky) s chronickým srdečním selháním [NYHA třída II-IV, ejekční frakce levé komory méně než 40 % u dětí se systémovou levou komorou (LV) a středně těžkou komorovou dysfunkcí kvalitativně podle echa u dětí se systémovou komorou, která nebyla LK], kteří dostávali standardní základní léčbu, byli randomizováni k placebu nebo ke 2 dávkovým hladinám karvedilolu. Tyto úrovně dávek vyvolaly snížení srdeční frekvence korigované placebem o 4 až 6 srdečních tepů za minutu, což ukazuje na aktivitu β-blokády. Expozice se zdála být nižší u pediatrických subjektů než u dospělých. Po 8 měsících sledování nebyl zaznamenán žádný významný vliv léčby na klinické výsledky. Nežádoucí účinky v této studii, které se vyskytly u více než 10 % subjektů léčených COREG a ve dvojnásobné míře než u subjektů léčených placebem, zahrnovaly bolest na hrudi (17 % oproti 6 %), závratě (13 % oproti 2 %) a dušnost ( 11 % oproti 0 %).
Geriatrické použití
Ze 765 subjektů se srdečním selháním randomizovaných k COREG 6,25 mg v klinických studiích v USA bylo 31 % (235) ve věku 65 let nebo více a 7,3 % (56) bylo ve věku 75 let nebo více. Z 1 156 subjektů randomizovaných k COREG 3,12 mg v dlouhodobé, placebem kontrolované studii u těžkého srdečního selhání bylo 47 % (547) ve věku 65 let nebo více a 15 % (174) bylo ve věku 75 let nebo starší. Z 3 025 subjektů užívajících COREG 6,25 mg ve studiích se srdečním selháním po celém světě bylo 42 % ve věku 65 let nebo více.
Z 975 subjektů s infarktem myokardu randomizovaných do COREG ve studii CAPRICORN bylo 48 % (468) ve věku 65 let nebo více a 11 % (111) bylo ve věku 75 let nebo více.
Z 2 065 pacientů s hypertenzí v klinických studiích účinnosti nebo bezpečnosti v USA, kteří byli léčeni přípravkem COREG 25 mg, bylo 21 % (436) ve věku 65 let nebo více. Z 3 722 subjektů užívajících COREG v klinických studiích hypertenze prováděných po celém světě bylo 24 % ve věku 65 let nebo více.
výjimkou závratí u hypertoniků (výskyt 8,8 % u starších osob oproti 6 % u mladších subjektů) nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti (viz obrázky 2 a 4) mezi staršími subjekty a mladšími subjekty v žádném z tyto populace. Podobně jiné hlášené klinické zkušenosti neidentifikovaly rozdíly v odpovědích mezi staršími a mladšími subjekty, nelze však vyloučit větší citlivost některých starších jedinců.
PŘEDÁVKOVAT
Předávkování může způsobit těžkou hypotenzi, bradykardii, srdeční insuficienci, kardiogenní šok a srdeční zástavu. Mohou se také objevit dýchací potíže, bronchospasmy, zvracení, poruchy vědomí a generalizované záchvaty.
Pacient by měl být uložen do polohy na zádech a v případě potřeby by měl být pod dohledem a léčen v podmínkách intenzivní péče. Mohou být podávány následující látky:
Při nadměrné bradykardii : Atropin, 2 mg IV.
Pro podporu kardiovaskulárních funkcí Glukagon, 5 až 10 mg IV rychle během 30 sekund, následuje kontinuální infuze 5 mg za hodinu; sympatomimetika (dobutamin, isoprenalin, adrenalin) v dávkách dle tělesné hmotnosti a účinku.
Pokud dominuje periferní vazodilatace, může být nutné podat adrenalin nebo noradrenalin s nepřetržitým sledováním oběhových poměrů. U bradykardie rezistentní na terapii by měla být provedena terapie kardiostimulátorem. Při bronchospasmu by měla být podána β-sympatomimetika (jako aerosol nebo IV) nebo aminofylin IV. V případě záchvatů se doporučuje pomalá IV injekce diazepamu nebo klonazepamu.
POZNÁMKA: V případě těžké intoxikace s příznaky šoku musí léčba antidoty pokračovat po dostatečně dlouhou dobu odpovídající 7 až 10 hodinovému poločasu karvedilolu.
Byly hlášeny případy předávkování přípravkem COREG 3,12 mg samotným nebo v kombinaci s jinými léky. Požitá množství v některých případech přesáhla 1000 miligramů. Projevené příznaky zahrnovaly nízký krevní tlak a srdeční frekvenci. Byla poskytnuta standardní podpůrná léčba a jednotlivci se uzdravili.
KONTRAINDIKACE
COREG 25mg je kontraindikován u následujících stavů:
- Bronchiální astma nebo související bronchospastické stavy. Po jednotlivých dávkách COREG byla hlášena úmrtí na status astmaticus.
- AV blokáda druhého nebo třetího stupně.
- Syndrom nemocného sinusu.
- Těžká bradykardie (pokud není zaveden trvalý kardiostimulátor).
- Pacienti s kardiogenním šokem nebo s dekompenzovaným srdečním selháním vyžadujícím použití intravenózní inotropní terapie. Tito pacienti by měli být před zahájením léčby přípravkem COREG nejprve odstaveni od intravenózní terapie.
- Pacienti s těžkou poruchou funkce jater.
- Pacienti s anamnézou závažné hypersenzitivní reakce (např. Stevens-Johnsonův syndrom, anafylaktická reakce, angioedém) na kteroukoli složku tohoto léku nebo jiné léky obsahující karvedilol.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
COREG 3,12 mg je racemická směs, ve které je neselektivní blokující aktivita β-adrenoreceptoru přítomna v S(-) enantiomeru a α1-adrenergní blokující aktivita je přítomna v R(+) i S(-) enantiomerech se stejnou účinností. COREG 6,25 mg nemá žádnou vnitřní sympatomimetickou aktivitu.
Farmakodynamika
Srdeční selhání
Základ pro příznivé účinky COREG při srdečním selhání není stanoven.
Dvě placebem kontrolované studie porovnávaly akutní hemodynamické účinky COREG s výchozími měřeními u 59 a 49 pacientů se srdečním selháním třídy NYHA II-IV, kteří dostávali diuretika, ACE inhibitory a digitalis. Došlo k významnému snížení systémového krevního tlaku, tlaku v plicnici, tlaku v zaklínění plicních kapilár a srdeční frekvence. Počáteční účinky na srdeční výdej, index tepového objemu a systémovou vaskulární rezistenci byly malé a variabilní.
Tyto studie měřily hemodynamické účinky znovu po 12 až 14 týdnech. COREG 25 mg významně snížil systémový krevní tlak, tlak v plicnici, tlak v pravé síni, systémový vaskulární odpor a srdeční frekvenci, zatímco index tepového objemu byl zvýšen.
839 subjektů se srdečním selháním třídy NYHA II-III léčených po dobu 26 až 52 týdnů ve 4 placebem kontrolovaných studiích v USA se průměrná ejekční frakce levé komory (EF) měřená radionuklidovou ventrikulografií zvýšila o 9 jednotek EF (%) u subjektů užívajících COREG 6,25 mg a o 2 jednotky EF u subjektů s placebem v cílové dávce 25 až 50 mg dvakrát denně. Účinky karvedilolu na ejekční frakci souvisely s dávkou. Dávky 6,25 mg dvakrát denně, 12,5 mg dvakrát denně a 25 mg dvakrát denně byly spojeny s placebem korigovaným zvýšením EF o 5 EF jednotek, 6 EF jednotek a 8 EF jednotek, v tomto pořadí; každý z těchto účinků byl nominálně statisticky významný.
Dysfunkce levé komory po infarktu myokardu
Základ pro příznivé účinky COREG 25 mg u pacientů s dysfunkcí levé komory po akutním infarktu myokardu není stanoven.
Hypertenze
Mechanismus, kterým β-blokáda vyvolává antihypertenzní účinek, nebyl stanoven.
Aktivita blokování β-adrenoreceptorů byla prokázána ve studiích na zvířatech a lidech, které ukazují, že karvedilol (1) snižuje srdeční výdej u normálních subjektů, (2) snižuje tachykardii vyvolanou cvičením a/nebo izoproterenolem a (3) snižuje reflexní ortostatickou tachykardii. Významný blokující účinek na β-adrenoreceptory je obvykle pozorován do 1 hodiny po podání léku.
Aktivita blokování α1-adrenoreceptoru byla prokázána ve studiích na lidech a zvířatech, což ukazuje, že karvedilol (1) zeslabuje presorické účinky fenylefrinu, (2) způsobuje vazodilataci a (3) snižuje periferní vaskulární rezistenci. Tyto účinky přispívají ke snížení krevního tlaku a obvykle se projeví do 30 minut po podání léku.
důsledku blokující aktivity karvedilolu na α1-receptory je krevní tlak snížen více ve stoji než v poloze na zádech a mohou se objevit příznaky posturální hypotenze (1,8 %), včetně vzácných případů synkopy. Po perorálním podání, když se objevila posturální hypotenze, byla přechodná a je méně častá, když se COREG podává s jídlem v doporučené počáteční dávce a titrační přírůstky jsou pečlivě sledovány (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
U hypertoniků s normální funkcí ledvin terapeutické dávky COREG snižovaly renální vaskulární rezistenci beze změny rychlosti glomerulární filtrace nebo průtoku plazmy ledvinami. Změny ve vylučování sodíku, draslíku, kyseliny močové a fosforu u hypertoniků s normální funkcí ledvin byly po COREG a placebu podobné.
COREG 3,12 mg má malý účinek na plazmatické katecholaminy, plazmatické hladiny aldosteronu nebo elektrolytů, ale významně snižuje aktivitu plazmatického reninu, pokud je podáván po dobu alespoň 4 týdnů. Zvyšuje také hladiny atriálního natriuretického peptidu.
Farmakokinetika
COREG se po perorálním podání rychle a rozsáhle absorbuje, s absolutní biologickou dostupností přibližně 25 % až 35 % v důsledku významného stupně metabolismu prvního průchodu játry. Po perorálním podání se zdánlivý průměrný terminální eliminační poločas karvedilolu obecně pohybuje od 7 do 10 hodin. Dosažené plazmatické koncentrace jsou úměrné podané perorální dávce. Při podávání s jídlem je rychlost absorpce zpomalena, o čemž svědčí zpoždění v době dosažení maximálních plazmatických hladin, bez významného rozdílu v rozsahu biologické dostupnosti. Užívání přípravku COREG s jídlem by mělo minimalizovat riziko ortostatické hypotenze.
Karvedilol je rozsáhle metabolizován. Po perorálním podání radioaktivně značeného karvedilolu zdravým dobrovolníkům představoval karvedilol pouze asi 7 % celkové radioaktivity v plazmě, měřeno plochou pod křivkou (AUC). Méně než 2 % dávky byla vyloučena v nezměněné podobě močí. Karvedilol je primárně metabolizován oxidací aromatických kruhů a glukuronidací.
Oxidační metabolity jsou dále metabolizovány konjugací přes glukuronidaci a sulfataci. Metabolity karvedilolu jsou vylučovány primárně žlučí do stolice. Demethylací a hydroxylací na fenolovém kruhu vznikají 3 aktivní metabolity s aktivitou blokující β-receptory. Na základě předklinických studií je metabolit 4'-hydroxyfenyl přibližně 13krát účinnější než karvedilol na β-blokádu.
Ve srovnání s karvedilolem vykazují 3 aktivní metabolity slabou vazodilatační aktivitu. Plazmatické koncentrace aktivních metabolitů tvoří asi jednu desetinu koncentrací pozorovaných u karvedilolu a mají podobnou farmakokinetiku jako původní metabolit.
Karvedilol podléhá stereoselektivnímu first-pass metabolismu s plazmatickými hladinami R(+)-karvedilolu přibližně 2 až 3krát vyššími než S(-)-karvedilol po perorálním podání zdravým subjektům. Průměrné zdánlivé terminální eliminační poločasy pro R(+)-karvedilol se pohybují od 5 do 9 hodin ve srovnání se 7 až 11 hodinami pro S(-)-enantiomer.
Primárními enzymy P450 odpovědnými za metabolismus R(+) i S(-)-karvedilolu v lidských jaterních mikrozomech byly CYP2D6 a CYP2C9 a v menší míře CYP3A4, 2C19, 1A2 a 2E1. Předpokládá se, že CYP2D6 je hlavním enzymem v 4'- a 5'-hydroxylaci karvedilolu s potenciálním přispěním 3A4. Předpokládá se, že CYP2C9 má primární význam v O-methylační dráze S(-)-karvedilolu.
Karvedilol podléhá účinkům genetického polymorfismu se slabými metabolizátory debrisochinu (marker pro cytochrom P450 2D6), kteří vykazují 2 až 3krát vyšší plazmatické koncentrace R(+)-karvedilolu ve srovnání s extenzivními metabolizátory. Naproti tomu plazmatické hladiny S(-)-karvedilolu jsou u pomalých metabolizátorů zvýšeny pouze o 20 % až 25 %, což naznačuje, že tento enantiomer je metabolizován v menší míře cytochromem P450 2D6 než R(+)-karvedilol. Zdá se, že farmakokinetika karvedilolu se u pomalých metabolizátorů S-mefenytoinu (pacienti s deficitem cytochromu P450 2C19) neliší.
Karvedilol se z více než 98 % váže na plazmatické proteiny, především na albumin. Vazba na plazmatické bílkoviny je nezávislá na koncentraci v terapeutickém rozmezí. Karvedilol je bazická lipofilní sloučenina s distribučním objemem v ustáleném stavu přibližně 115 l, což ukazuje na podstatnou distribuci do extravaskulárních tkání. Plazmatická clearance se pohybuje od 500 do 700 ml/min.
Specifické populace
Srdeční selhání
Plazmatické koncentrace karvedilolu a jeho enantiomerů v ustáleném stavu se u subjektů se srdečním selháním úměrně zvýšily v rozmezí dávek 6,25 až 50 mg. Ve srovnání se zdravými subjekty měly subjekty se srdečním selháním zvýšené průměrné hodnoty AUC a Cmax pro karvedilol a jeho enantiomery, přičemž až o 50 % až 100 % vyšší hodnoty byly pozorovány u 6 subjektů se srdečním selháním třídy NYHA IV. Průměrný zdánlivý terminální eliminační poločas karvedilolu byl podobný jako u zdravých subjektů.
Geriatrický
Plazmatické hladiny karvedilolu v průměru o 50 % vyšší u starších osob ve srovnání s mladými subjekty. Poškození jater Ve srovnání se zdravými jedinci vykazují pacienti s těžkým poškozením jater (cirhózou) 4 až 7násobné zvýšení hladin karvedilolu. Karvedilol je kontraindikován u pacientů s těžkou poruchou funkce jater.
Renální poškození
Přestože je karvedilol metabolizován primárně v játrech, u pacientů s poruchou funkce ledvin byly hlášeny zvýšené plazmatické koncentrace karvedilolu. Na základě průměrných údajů AUC byly pozorovány přibližně o 40 % až 50 % vyšší plazmatické koncentrace karvedilolu u subjektů s hypertenzí a středně těžkou až těžkou poruchou funkce ledvin ve srovnání s kontrolní skupinou subjektů s hypertenzí a normální funkcí ledvin. Rozmezí hodnot AUC však byla pro obě skupiny podobná. Změny průměrných maximálních plazmatických hladin byly méně výrazné, přibližně o 12 % až 26 % vyšší u subjektů s poruchou funkce ledvin.
V souladu s vysokým stupněm vazby na plazmatické proteiny se karvedilol nezdá být významně odstraňován hemodialýzou.
Lékové interakce
Protože karvedilol podléhá značnému oxidativnímu metabolismu, metabolismus a farmakokinetika karvedilolu mohou být ovlivněny indukcí nebo inhibicí enzymů cytochromu P450.
Amiodaron
Ve farmakokinetické studii provedené u 106 japonských subjektů se srdečním selháním vedlo současné podávání malých nasycovacích a udržovacích dávek amiodaronu s karvedilolem k nejméně dvojnásobnému zvýšení minimálních koncentrací S(-)-karvedilolu v ustáleném stavu [viz DROGOVÉ INTERAKCE ].
Cimetidin
Ve farmakokinetické studii provedené u 10 zdravých mužů zvýšil cimetidin (1 000 mg denně) AUC karvedilolu v ustáleném stavu o 30 % beze změny Cmax [viz DROGOVÉ INTERAKCE ].
Digoxin
Po současném podávání karvedilolu (25 mg jednou denně) a digoxinu (0,25 mg jednou denně) po dobu 14 dnů se AUC v ustáleném stavu a minimální koncentrace digoxinu zvýšily o 14 % a 16 %, v tomto pořadí, u 12 pacientů s hypertenzí (viz DROGOVÉ INTERAKCE ].
Glyburide
U 12 zdravých subjektů nevedlo kombinované podávání karvedilolu (25 mg jednou denně) a jedné dávky glyburidu ke klinicky relevantní farmakokinetické interakci pro žádnou ze sloučenin.
hydrochlorothiazid
Jednorázová perorální dávka karvedilolu 25 mg nezměnila farmakokinetiku jednorázové perorální dávky 25 mg hydrochlorothiazidu u 12 subjektů s hypertenzí. Stejně tak hydrochlorothiazid neměl žádný vliv na farmakokinetiku karvedilolu.
rifampin
Ve farmakokinetické studii provedené na 8 zdravých mužských subjektech snížil rifampin (600 mg denně po dobu 12 dnů) AUC a Cmax karvedilolu asi o 70 % [viz DROGOVÉ INTERAKCE ].
Torsemide
Ve studii s 12 zdravými subjekty nevedlo kombinované perorální podávání karvedilolu 25 mg jednou denně a torsemidu 5 mg jednou denně po dobu 5 dnů k žádným významným rozdílům v jejich farmakokinetice ve srovnání s podáváním samotných léků.
Warfarin
Karvedilol (12,5 mg dvakrát denně) neměl vliv na poměry protrombinového času v ustáleném stavu a neměnil farmakokinetiku R(+)- a S(-)-warfarinu po současném podávání s warfarinem u 9 zdravých dobrovolníků.
Klinické studie
Srdeční selhání
placebem kontrolovaných studiích karvedilolu bylo hodnoceno celkem 6 975 subjektů s mírným až závažným srdečním selháním.
Mírné až středně těžké srdeční selhání
Karvedilol byl studován v 5 multicentrických, placebem kontrolovaných studiích a v 1 aktivně kontrolované studii (studie COMET) zahrnující subjekty s mírným až středně těžkým srdečním selháním.
Čtyři americké multicentrické, dvojitě zaslepené, placebem kontrolované studie zahrnovaly 1 094 subjektů (696 randomizovaných na karvedilol) se srdečním selháním třídy NYHA II-III a ejekční frakcí nižší nebo rovnou 0,35. Velká většina byla při vstupu do studie na digitalisu, diuretikách a inhibitoru ACE. Pacienti byli zařazeni do studií na základě schopnosti cvičení. Do australsko-novozélandské dvojitě zaslepené, placebem kontrolované studie bylo zařazeno 415 subjektů (napůl randomizovaných na karvedilol) s méně závažným srdečním selháním. Všechny protokoly vylučovaly subjekty, u kterých se očekávalo, že podstoupí transplantaci srdce během 7,5 až 15 měsíců dvojitě zaslepeného sledování. Všichni randomizovaní jedinci tolerovali 2týdenní léčbu karvedilolem 6,25 mg dvakrát denně.
každé studii byl primární cílový bod, buď progrese srdečního selhání (1 studie v USA) nebo tolerance zátěže (2 studie v USA splňující cílové cíle a australsko-novozélandská studie). V těchto studiích bylo specifikováno mnoho sekundárních cílových bodů, včetně klasifikace NYHA, celkového hodnocení pacienta a lékaře a kardiovaskulární hospitalizace. Další analýzy, které nebyly prospektivně plánovány, zahrnovaly součet úmrtí a celkových kardiovaskulárních hospitalizací. V situacích, kdy primární koncové body studie nevykazují významný přínos léčby, je přiřazení hodnot významnosti ostatním výsledkům složité a takové hodnoty je třeba interpretovat opatrně.
Výsledky studií v USA a Austrálii a Novém Zélandu byly následující:
Zpomalení progrese srdečního selhání
Jedna multicentrická studie v USA (366 subjektů) měla jako primární cílový bod součet kardiovaskulární mortality, kardiovaskulární hospitalizace a trvalého nárůstu léků na srdeční selhání. Progrese srdečního selhání byla snížena během průměrné doby sledování 7 měsíců o 48 % (P = 0,008).
V australsko-novozélandské studii se počet úmrtí a celkový počet hospitalizací během 18 až 24 měsíců snížil asi o 25 %. Ve 3 největších studiích v USA se počet úmrtí a celkový počet hospitalizací snížil o 19 %, 39 % a 49 %, což je nominálně statisticky významné v posledních 2 studiích. Výsledky Austrálie a Nového Zélandu byly statisticky hraniční.
Funkční opatření
Žádná z multicentrických studií neměla klasifikaci NYHA jako primární cílový bod, ale všechny takové studie ji měly jako sekundární cílový bod. Ve všech studiích byl alespoň trend ke zlepšení ve třídě NYHA. Tolerance zátěže byla primárním koncovým bodem ve 3 studiích; v žádném nebyl zjištěn statisticky významný účinek.
Subjektivní opatření
Kvalita života související se zdravím, měřená standardním dotazníkem (primární cílový bod v 1 studii), nebyla karvedilolem ovlivněna. Globální hodnocení pacientů a zkoušejících však ve většině studií ukázalo významné zlepšení.
Úmrtnost
Smrt nebyla předem specifikovaným koncovým bodem v žádné studii, ale byla analyzována ve všech studiích. Celkově se v těchto 4 studiích v USA mortalita snížila, nominálně významně tak ve 2 studiích.
Zkouška COMET
této dvojitě zaslepené studii bylo 3 029 subjektů se srdečním selháním třídy NYHA II-IV (ejekční frakce levé komory menší nebo rovna 35 %) randomizováno k podávání buď karvedilolu (cílová dávka: 25 mg dvakrát denně) nebo metoprololu s okamžitým uvolňováním tartrát (cílová dávka: 50 mg dvakrát denně). Průměrný věk subjektů byl přibližně 62 let, 80 % byli muži a průměrná ejekční frakce levé komory na počátku byla 26 %. Přibližně 96 % subjektů mělo srdeční selhání třídy NYHA II nebo III. Souběžná léčba zahrnovala diuretika (99 %), ACE inhibitory (91 %), digitalis (59 %), antagonisty aldosteronu (11 %) a „statinové“ látky snižující lipidy (21 %). Průměrná doba sledování byla 4,8 roku. Průměrná dávka karvedilolu byla 42 mg denně.
Studie měla 2 primární cílové body: mortalitu ze všech příčin a kombinaci úmrtí plus hospitalizace z jakéhokoli důvodu. Výsledky COMET jsou uvedeny v tabulce 3 níže. Úmrtnost ze všech příčin nesla většinu statistické váhy a byla primárním determinantem velikosti pokusu. Úmrtnost ze všech příčin byla 34 % u subjektů léčených karvedilolem a 40 % ve skupině s metoprololem s okamžitým uvolňováním (P = 0,0017; poměr rizika = 0,83, 95% CI: 0,74 až 0,93). Účinek na mortalitu byl způsoben především snížením kardiovaskulárních úmrtí. Rozdíl mezi těmito 2 skupinami s ohledem na složený cílový bod nebyl významný (P = 0,122). Odhadované průměrné přežití bylo 8,0 let s karvedilolem a 6,6 let s metoprololem s okamžitým uvolňováním.
Není známo, zda tato formulace metoprololu v jakékoli dávce nebo tato nízká dávka metoprololu v jakékoli formulaci má nějaký účinek na přežití nebo hospitalizaci u pacientů se srdečním selháním. Tato studie tedy prodlužuje dobu, po kterou karvedilol vykazuje přínosy pro přežití při srdečním selhání, ale není důkazem, že karvedilol zlepšuje výsledky oproti formulaci metoprololu (TOPROL-XL) s přínosem při srdečním selhání.
Těžké srdeční selhání (COPERNICUS)
Ve dvojitě zaslepené studii (COPERNICUS) bylo 2 289 subjektů se srdečním selháním v klidu nebo s minimální námahou a ejekční frakcí levé komory nižší než 25 % (průměr 20 %), a to navzdory digitalisu (66 %), diuretikům (99 %) a ACE inhibitory (89 %) byly randomizovány k placebu nebo karvedilolu. Karvedilol byl titrován z počáteční dávky 3,125 mg dvakrát denně na maximální tolerovanou dávku nebo až na 25 mg dvakrát denně po dobu minimálně 6 týdnů. Většina subjektů dosáhla cílové dávky 25 mg. Zkouška byla provedena ve východní a západní Evropě, Spojených státech, Izraeli a Kanadě. Podobný počet subjektů na skupinu (přibližně 100) se stáhl během období titrace.
Primárním koncovým bodem studie byla mortalita ze všech příčin, ale byla zkoumána také mortalita specifická pro příčinu a riziko úmrtí nebo hospitalizace (celkové, kardiovaskulární [CV] nebo srdeční selhání [HF]). Vyvíjející se data ze studie sledovala komise pro monitorování dat a analýzy úmrtnosti byly upraveny pro tyto vícenásobné vzhledy. Studie byla zastavena po střední době sledování 10 měsíců kvůli pozorovanému 35% snížení mortality (z 19,7 % na pacientorok na placebu na 12,8 % na karvedilolu; poměr rizika 0,65, 95% CI: 0,52 až 0,81, P = 0,0014, upraveno) (viz obrázek 1). Výsledky COPERNICUS jsou uvedeny v tabulce 4.
Obrázek 1. Analýza přežití pro COPERNICUS (intent-to-treat) 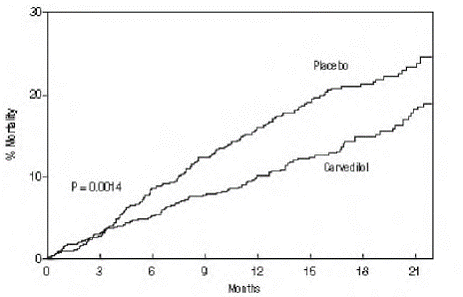
Účinek na mortalitu byl v zásadě důsledkem snížení míry náhlé smrti mezi subjekty bez zhoršení srdečního selhání.
Globální hodnocení pacientů, ve kterých byly subjekty léčené karvedilolem srovnávány s placebem, byla založena na předem specifikovaných, pravidelných pacientských sebehodnoceních, zda klinický stav po léčbě vykazoval zlepšení, zhoršení nebo žádnou změnu ve srovnání s výchozí hodnotou. Subjekty léčené karvedilolem vykázaly v COPERNICUS významné zlepšení v globálním hodnocení ve srovnání s těmi, kteří byli léčeni placebem.
V protokolu bylo také uvedeno, že se budou posuzovat hospitalizace. Méně subjektů užívajících COREG 6,25 mg než placebo bylo hospitalizováno z jakéhokoli důvodu (372 oproti 432, P = 0,0029), z kardiovaskulárních důvodů (246 oproti 314, P = 0,0003) nebo pro zhoršení srdečního selhání (198 oproti 268, P = 0,0001 ).
COREG 6,25 mg měl konzistentní a příznivý účinek na úmrtnost ze všech příčin a také na kombinované cílové ukazatele úmrtnosti ze všech příčin plus hospitalizace (celková, KV nebo pro srdeční selhání) v celkové populaci studie a ve všech zkoumaných podskupinách, včetně muži a ženy, starší lidé a starší lidé, černoši a nečernoši a diabetici a nediabetici (viz obrázek 2).
Obrázek 2. Účinky na mortalitu pro podskupiny v COPERNICUS 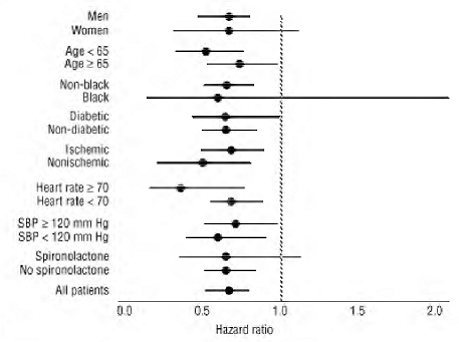
Dysfunkce levé komory po infarktu myokardu
CAPRICORN byla dvojitě zaslepená studie porovnávající karvedilol a placebo u 1 959 subjektů s nedávným infarktem myokardu (během 21 dnů) a ejekční frakcí levé komory nižší nebo rovnou 40 %, s (47 %) nebo bez příznaků srdečního selhání. Subjekty, kterým byl podáván karvedilol, dostávaly 6,25 mg dvakrát denně, titrované podle tolerance na 25 mg dvakrát denně. Subjekty musely mít systolický krevní tlak vyšší než 90 mm Hg, srdeční frekvenci vsedě vyšší než 60 tepů za minutu a žádnou kontraindikaci k použití β-blokátoru. Léčba indexového infarktu zahrnovala aspirin (85 %), IV nebo perorální β-blokátory (37 %), nitráty (73 %), heparin (64 %), trombolytika (40 %) a akutní angioplastiku (12 %). Základní léčba zahrnovala ACE inhibitory nebo blokátory angiotenzinových receptorů (97 %), antikoagulancia (20 %), hypolipidemika (23 %) a diuretika (34 %). Základní charakteristiky populace zahrnovaly průměrný věk 63 let, 74 % mužů, 95 % bělochů, průměrný krevní tlak 121/74 mm Hg, 22 % s diabetem a 54 % s anamnézou hypertenze. Průměrná dosažená dávka karvedilolu byla 20 mg dvakrát denně; průměrná doba sledování byla 15 měsíců.
Mortalita ze všech příčin byla 15 % ve skupině s placebem a 12 % ve skupině s karvedilolem, což ukazuje na 23% snížení rizika u subjektů léčených karvedilolem (95% CI: 2 % až 40 %, P = 0,03), jak ukazuje obrázek 3. Účinky na mortalitu v různých podskupinách jsou znázorněny na obrázku 4. Téměř všechna úmrtí byla kardiovaskulární (která byla snížena o 25 % karvedilolem) a většina těchto úmrtí byla náhlá nebo související se selháním pumpy (oba typy úmrtí byly sníženy karvedilolem). Další cílový bod studie, celková mortalita a hospitalizace ze všech příčin, nevykazovaly významné zlepšení.
Ve skupině léčené karvedilolem bylo také pozorováno významné 40% snížení fatálního nebo nefatálního infarktu myokardu (95% CI: 11 % až 60 %, P = 0,01). Podobné snížení rizika infarktu myokardu bylo také pozorováno v metaanalýze placebem kontrolovaných studií karvedilolu u srdečního selhání.
Obrázek 3. Analýza přežití pro KOZOROH (záměr léčby) 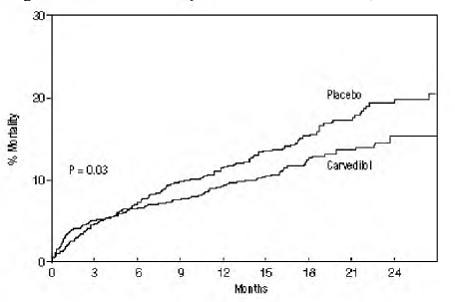
Obrázek 4. Účinky na úmrtnost pro podskupiny KOZOROHA 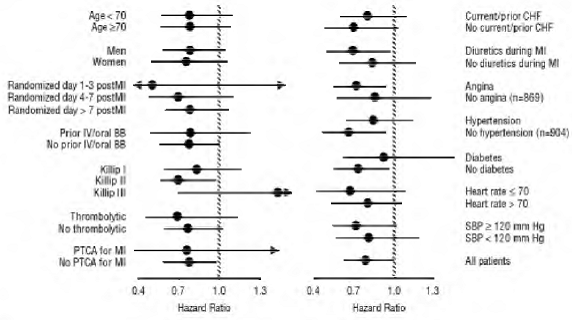
Hypertenze
COREG 25 mg byl studován ve 2 placebem kontrolovaných studiích, které využívaly dávkování dvakrát denně v celkových denních dávkách 12,5 až 50 mg. V těchto a dalších studiích počáteční dávka nepřesáhla 12,5 mg. Při dávce 50 mg denně COREG snížil krevní tlak v sedě (12 hodin) přibližně o 9/5,5 mm Hg; při 25 mg denně byl účinek asi 7,5/3,5 mm Hg. Srovnání krevního tlaku mezi nejnižšími a nejvyššími hodnotami prokázalo poměr mezi nejnižšími a nejvyššími hodnotami pro odezvu krevního tlaku asi 65 %. Srdeční frekvence klesla asi o 7,5 tepů za minutu při dávce 50 mg denně. Obecně, stejně jako u jiných β-blokátorů, byly odpovědi menší u černochů než u nečerných jedinců. Nebyly zjištěny žádné rozdíly v odpovědi související s věkem nebo pohlavím.
Vrchol antihypertenzního účinku se objevil za 1 až 2 hodiny po podání dávky. Reakce krevního tlaku související s dávkou byla doprovázena zvýšením nežádoucích účinků souvisejícím s dávkou [viz NEŽÁDOUCÍ REAKCE ].
Hypertenze s diabetes mellitus 2. typu
Ve dvojitě zaslepené studii (GEMINI) byl přípravek COREG 25 mg přidaný k inhibitoru ACE nebo blokátoru receptoru angiotenzinu hodnocen v populaci s mírnou až středně těžkou hypertenzí a dobře kontrolovaným diabetes mellitus 2. typu. Průměrná výchozí hodnota HbA1c byla 7,2 %. COREG byl titrován na průměrnou dávku 17,5 mg dvakrát denně a udržován po dobu 5 měsíců. COREG neměl žádný nepříznivý účinek na glykemickou kontrolu na základě měření HbA1c (průměrná změna od výchozí hodnoty 0,02 %, 95% CI: -0,06 až 0,10, P = NS) [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
INFORMACE PRO PACIENTA
COREG (Co-REG) (karvedilol) Tablety
Přečtěte si informace pro pacienty, které jsou dodávány s COREG, než jej začnete užívat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tyto informace nenahrazují rozhovor s lékařem o vašem zdravotním stavu nebo léčbě. Máte-li jakékoli otázky týkající se COREG 3,12 mg, zeptejte se svého lékaře nebo lékárníka.
Co je COREG 3,12 mg?
COREG je lék na předpis, který patří do skupiny léků nazývaných „beta-blokátory“. COREG 6,25 mg se používá, často s jinými léky, při následujících stavech:
- k léčbě pacientů s určitými typy srdečního selhání
- k léčbě pacientů, kteří měli srdeční infarkt, který zhoršil, jak dobře srdce pumpuje
- k léčbě pacientů s vysokým krevním tlakem (hypertenzí)
COREG není schválen pro použití u dětí mladších 18 let.
Kdo by neměl užívat COREG?
Neužívejte COREG 6,25 mg, jestliže:
- trpíte závažným srdečním selháním a jste hospitalizováni na jednotce intenzivní péče nebo vyžadují určité nitrožilní léky, které pomáhají podporovat oběh (inotropní léky).
- jsou náchylní k astmatu nebo jiným dýchacím potížím.
- máte pomalý srdeční tep nebo srdce, které vynechává tep (nepravidelný srdeční tep).
- mít problémy s játry.
- jsou alergičtí na kteroukoli složku COREG. Účinnou látkou je karvedilol. Seznam všech složek přípravku COREG naleznete na konci této příbalové informace.
Co mám říct svému lékaři, než začnu užívat COREG?
Informujte svého lékaře o všech svých zdravotních stavech, včetně toho, zda:
- máte astma nebo jiné plicní problémy (jako je bronchitida nebo emfyzém).
- máte problémy s průtokem krve v chodidlech a nohou (onemocnění periferních cév). COREG 3,12 mg může některé vaše příznaky zhoršit.
- mít cukrovku.
- mít problémy se štítnou žlázou.
- trpíte stavem zvaným feochromocytom.
- měli závažné alergické reakce.
- jste těhotná nebo se snažíte otěhotnět. Není známo, zda je COREG bezpečný pro vaše nenarozené dítě. Vy a váš lékař byste si měli promluvit o nejlepším způsobu kontroly vysokého krevního tlaku během těhotenství.
- kojí. Není známo, zda COREG přechází do vašeho mateřského mléka. Promluvte si se svým lékařem o nejlepším způsobu krmení dítěte, pokud užíváte COREG.
- jsou naplánováni na operaci a dostanou anestetika.
- jsou naplánováni na operaci šedého zákalu a užívali nebo v současné době užívají COREG.
- užíváte léky na předpis nebo volně prodejné léky, vitamíny a bylinné doplňky. COREG a některé další léky se mohou navzájem ovlivňovat a způsobit závažné nežádoucí účinky. COREG 3,12 mg může ovlivnit způsob účinku jiných léků. Také jiné léky mohou ovlivnit účinnost přípravku COREG 25 mg.
Uchovávejte si seznam všech léků, které užíváte. Než začnete užívat nový lék, ukažte tento seznam svému lékaři a lékárníkovi.
Jak mám užívat COREG?
Je důležité, abyste svůj lék užívali každý den podle pokynů svého lékaře. Pokud přestanete užívat COREG náhle, můžete mít bolest na hrudi a/nebo srdeční infarkt. Pokud váš lékař rozhodne, že byste měl(a) přestat užívat COREG 6,25 mg, může vám lékař po určitou dobu pomalu snižovat dávku, než ji úplně vysadí.
- Užívejte COREG přesně podle předpisu. Váš lékař vám řekne, kolik tablet máte užívat a jak často. Aby se minimalizovaly možné nežádoucí účinky, může Váš lékař začít s nízkou dávkou a poté dávku pomalu zvyšovat.
- Bez porady se svým lékařem nepřestávejte užívat COREG a neměňte množství COREG, které užíváte.
- Informujte svého lékaře, pokud během užívání přípravku COREG přiberete na váze nebo máte potíže s dýcháním.
- Užívejte COREG s jídlem.
- Pokud zapomenete užít dávku COREG 3,12 mg, vezměte si dávku, jakmile si vzpomenete, pokud není čas užít si další dávku. Užijte další dávku v obvyklou dobu. Neužívejte 2 dávky současně.
- Pokud užijete příliš mnoho COREG 25 mg, okamžitě zavolejte svého lékaře nebo toxikologické centrum.
Čemu se mám vyhnout při užívání COREG 3,12 mg?
- COREG vám může způsobit závratě, únavu nebo mdloby. Pokud máte tyto příznaky, neřiďte auto, neobsluhujte stroje ani nedělejte nic, co vyžaduje, abyste byli ve střehu.
Jaké jsou možné vedlejší účinky COREG?
- Nízký krevní tlak (který může způsobit závratě nebo mdloby, když vstanete). Pokud k tomu dojde, ihned si sedněte nebo lehněte a informujte svého lékaře.
- Únava. Pokud se cítíte unavení nebo máte závratě, neměli byste řídit, obsluhovat stroje ani dělat nic, co vyžaduje, abyste byli ve střehu.
- Pomalý tep.
- Změny hladiny cukru v krvi. Pokud máte cukrovku, informujte svého lékaře, pokud máte nějaké změny hladiny cukru v krvi.
- COREG může skrývat některé příznaky nízké hladiny cukru v krvi, zejména rychlý srdeční tep.
- COREG může maskovat příznaky hypertyreózy (nadměrná činnost štítné žlázy).
- Zhoršení závažných alergických reakcí.
- U pacientů užívajících COREG se vyskytly vzácné, ale závažné alergické reakce (včetně kopřivky nebo otoku obličeje, rtů, jazyka a/nebo hrdla, které mohou způsobit potíže s dýcháním nebo polykáním). Tyto reakce mohou být život ohrožující.
Mezi další vedlejší účinky COREG patří dušnost, přírůstek hmotnosti, průjem a méně slz nebo suchých očí, které se stávají obtěžujícími, pokud nosíte kontaktní čočky.
Zavolejte svého lékaře, pokud máte nějaké nežádoucí účinky, které vás obtěžují nebo nezmizí.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA1088.
Jak mám uchovávat COREG 6,25 mg?
- COREG skladujte při teplotě nižší než 86°F (30°C). Udržujte tablety v suchu.
- COREG, který je zastaralý nebo již nepotřebný, bezpečně vyhoďte.
- Uchovávejte COREG 6,25 mg a všechny léky mimo dosah dětí.
Obecné informace o COREG
Léky jsou někdy předepisovány na jiné stavy, než jaké jsou popsány v příbalových informacích pro pacienty. Nepoužívejte COREG 3,12 mg pro stav, pro který nebyl předepsán. Nedávejte COREG jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták shrnuje nejdůležitější informace o COREG. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku COREG 6,25 mg, který je určen pro zdravotnické pracovníky.
Jaké jsou složky v COREG?
Aktivní složka: karvedilol.
Neaktivní složky: koloidní oxid křemičitý, krospovidon, hypromelóza, laktóza, stearát hořečnatý, polyethylenglykol, polysorbát 80, povidon, sacharóza a oxid titaničitý.
Tablety karvedilolu se dodávají v následujících silách: 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
Co je vysoký krevní tlak (hypertenze)?
Krevní tlak je síla krve ve vašich krevních cévách, když vaše srdce bije a když vaše srdce odpočívá. Máte vysoký krevní tlak, když je síla příliš velká. Vysoký krevní tlak způsobuje, že srdce hůře pumpuje krev tělem a způsobuje poškození krevních cév. COREG může pomoci uvolnit vaše krevní cévy, takže váš krevní tlak je nižší. Léky, které snižují krevní tlak, mohou snížit riziko mrtvice nebo srdečního infarktu.
