Avapro 150mg, 300mg Irbesartan Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Avapro 300 mg a jak se používá?
Avapro 300 mg je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze), bolesti nervů způsobené diabetem 2. Avapro lze užívat samostatně nebo s jinými léky.
Avapro 300 mg patří do třídy léků ARB.
Není známo, zda je přípravek Avapro 150 mg bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Avapro 300 mg?
Avapro může způsobit závažné nežádoucí účinky včetně:
- nevysvětlitelná bolest svalů,
- citlivost nebo slabost,
- horečka,
- neobvyklá únava,
- tmavě zbarvená moč,
- točení hlavy,
- malé nebo žádné močení,
- otok,
- rychlý nárůst hmotnosti,
- zmatek,
- ztráta chuti k jídlu,
- zvracení a
- bolest v boku nebo dolní části zad
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Avapro patří:
- průjem,
- pálení žáhy,
- podrážděný žaludek a
- pocit únavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Avapro. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
- Po zjištění těhotenství přerušte co nejdříve AVAPRO.
- Léky, které působí přímo na renin-angiotens v systému, mohou způsobit zranění a smrt vyvíjejícího se plodu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
POPIS
AVAPRO (irbesartan) je antagonista receptoru angiotenzinu II (podtyp AT1).
Irbesartan je nepeptidová sloučenina, chemicky popsaná jako 2-butyl-3-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]-1,3-diazaspiro[4.4]non-1-en-4 -jeden.
Jeho empirický vzorec je C25H28N6O a strukturní vzorec:
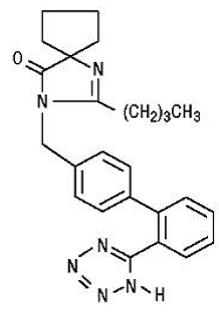
Irbesartan je bílý až téměř bílý krystalický prášek s molekulovou hmotností 428,5. Je to nepolární sloučenina s rozdělovacím koeficientem (oktanol/voda) 10,1 při pH 7,4. Irbesartan je těžce rozpustný v alkoholu a methylenchloridu a prakticky nerozpustný ve vodě.
AVAPRO je k dispozici pro perorální podání v tabletách bez rýhy obsahujících 75 mg, 150 mg nebo 300 mg irbesartanu. Mezi neaktivní složky patří: laktóza, mikrokrystalická celulóza, předbobtnalý škrob, sodná sůl kroskarmelózy, poloxamer 188, oxid křemičitý a stearát hořečnatý.
INDIKACE
Hypertenze
AVAPRO® je indikován k léčbě hypertenze, ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko fatálních a nefatálních kardiovaskulárních (KV) příhod, především mrtvice a infarktu myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd včetně tohoto léčiva.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než 1 lék. Konkrétní rady ohledně cílů a managementu naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak (National High Blood Pressure Education Program).
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu a lze dojít k závěru, že se jedná o snížení krevního tlaku a ne o některé další farmakologické vlastnosti. léky, které jsou z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika cévní mozkové příhody, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je v populacích podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů by se dalo očekávat těžit z agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie.
AVAPRO 300 mg lze užívat samostatně nebo v kombinaci s jinými antihypertenzivy.
Nefropatie u pacientů s diabetem 2. typu
AVAPRO je indikováno k léčbě diabetické nefropatie u pacientů s diabetem 2. typu a hypertenzí, zvýšeným sérovým kreatininem a proteinurií (>300 mg/den). V této populaci AVAPRO snižuje rychlost progrese nefropatie měřenou výskytem zdvojnásobení sérového kreatininu nebo terminálního onemocnění ledvin (potřeba dialýzy nebo transplantace ledvin) (viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Obecné úvahy
AVAPRO může být podáván s jinými antihypertenzivy as jídlem nebo bez jídla.
Hypertenze
Doporučená počáteční dávka přípravku AVAPRO 300 mg je 150 mg jednou denně. Dávkování může být zvýšeno na maximální dávku 300 mg jednou denně podle potřeby ke kontrole krevního tlaku [viz Klinické studie ].
Nefropatie u pacientů s diabetem 2. typu
Doporučená dávka je 300 mg jednou denně [viz Klinické studie ].
Úprava dávky u pacientů s ochuzeným objemem a solí
Doporučená počáteční dávka je 75 mg jednou denně u pacientů s deplecí intravaskulárního objemu nebo soli (např. u pacientů intenzivně léčených diuretiky nebo na hemodialýze) (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
JAK DODÁVÁNO
Dávkové formy A Síly
AVAPRO 75 mg je bílá až téměř bílá, bikonvexní oválná potahovaná tableta s vyraženým srdcem na jedné straně a „2871“ na druhé straně.
AVAPRO 150 mg je bílá až téměř bílá, bikonvexní oválná potahovaná tableta s vyraženým srdcem na jedné straně a „2872“ na druhé straně.
AVAPRO 300 mg je bílá až téměř bílá, bikonvexní oválná potahovaná tableta s vyraženým srdcem na jedné straně a „2873“ na druhé straně.
Skladování A Manipulace
AVAPRO (irbesartan) je dostupný jako bílé až téměř bílé, bikonvexní oválné, potahované tablety s vyraženým tvarem srdce na jedné straně a kódem na druhé straně (viz tabulka níže). Lahvičky pro jedno použití obsahují 30 nebo 90 potahovaných tablet takto:
Skladujte při teplotě 25 °C (77 °F); výlety povoleny do 15 °C – 30 °C (59 °F – 86 °F) [viz USP řízená pokojová teplota ].
sanofi-aventis US LLC, Bridgewater, NJ 08807, SPOLEČNOST SANOFI. Upraveno: září 2021
VEDLEJŠÍ EFEKTY
Následující důležité nežádoucí účinky jsou popsány jinde v označení:
- Hypotenze u pacientů se sníženým objemem nebo solí [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
- Porucha funkce ledvin [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi. Informace o nežádoucích účincích z klinických studií však poskytují základ pro identifikaci nežádoucích příhod, které se zdají souviset s užíváním drog, a pro přibližné míry.
Hypertenze
Bezpečnost přípravku AVAPRO byla hodnocena u více než 4 300 pacientů s hypertenzí a celkově u přibližně 5 000 subjektů. Tato zkušenost zahrnuje 1303 pacientů léčených déle než 6 měsíců a 407 pacientů 1 rok nebo déle.
placebem kontrolovaných klinických studiích byly následující nežádoucí účinky hlášeny u nejméně 1 % pacientů léčených přípravkem AVAPRO (n=1965) a s vyšší incidencí oproti placebu (n=641), s výjimkou těch, které jsou příliš obecné na to, aby byly informativní, a těch nejsou přiměřeně spojeny s užíváním drogy, protože byly spojeny s léčeným stavem nebo jsou v léčené populaci velmi časté, zahrnují: průjem (3 % vs. 2 %), dyspepsii/pálení žáhy (2 % vs. 1 %) a únavu (4 % vs. 3 %).
Užívání irbesartanu nebylo spojeno se zvýšeným výskytem suchého kašle, jak je typicky spojeno s užíváním ACE inhibitorů. V placebem kontrolovaných studiích byla incidence kašle u pacientů léčených irbesartanem 2,8 % oproti 2,7 % u pacientů užívajících placebo.
Nefropatie u pacientů s diabetem 2. typu
Hyperkalémie
Ve studii Irbesartan Diabetic Nephropathy Trial (IDNT) (proteinurie ≥900 mg/den a sérový kreatinin v rozmezí 1,0-3,0 mg/dl) bylo procento pacientů s draslíkem >6 mEq/l 18,6 % ve skupině AVAPRO 300 mg oproti 6,0 % ve skupině s placebem. Přerušení z důvodu hyperkalémie ve skupině AVAPRO 150 mg byla 2,1 % oproti 0,4 % ve skupině s placebem.
U IDNT byly nežádoucí účinky podobné těm, které byly pozorovány u pacientů s hypertenzí, s výjimkou zvýšeného výskytu ortostatických příznaků, které se vyskytovaly častěji ve skupině AVAPRO 150 mg oproti skupině s placebem: závratě (10,2 % vs. 6,0 %), ortostatické závratě (5,4 % vs 2,7 %) a ortostatická hypotenze (5,4 % vs 3,2 %).
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání přípravku AVAPRO po schválení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
kopřivka; angioedém (zahrnující otok obličeje, rtů, hltanu a/nebo jazyka); anafylaktická reakce včetně anafylaktického šoku; zvýšené jaterní testy; žloutenka; hepatitida; hyperkalémie; anémie; trombocytopenie; zvýšená CPK; tinnitus; a hypoglykémie u diabetických pacientů.
DROGOVÉ INTERAKCE
Činidla zvyšující sérový draslík
Současné podávání přípravku AVAPRO s jinými léky, které zvyšují hladinu draslíku v séru, může vést k hyperkalémii, někdy závažné. U těchto pacientů monitorujte hladinu draslíku v séru.
Lithium
Při současném užívání irbesartanu a lithia bylo hlášeno zvýšení sérových koncentrací lithia a toxicity lithia. Monitorujte hladiny lithia u pacientů užívajících irbesartan a lithium.
Nesteroidní protizánětlivé léky (NSAID) včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2)
pacientů, kteří jsou starší, s deplecí objemu (včetně těch, kteří jsou léčeni diuretiky) nebo s oslabenou funkcí ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s antagonisty receptoru angiotenzinu II (včetně irbesartanu) vést ke zhoršení funkce ledvin včetně možného akutního selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů léčených irbesartanem a NSAID pravidelně monitorujte renální funkce.
Antihypertenzní účinek antagonistů receptoru angiotenzinu II, včetně irbesartanu, může být zeslaben NSAID včetně selektivních inhibitorů COX-2.
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, hyperkalemie a změn renálních funkcí (včetně akutního renálního selhání) ve srovnání s monoterapií. Většina pacientů užívajících kombinaci dvou inhibitorů RAS nezíská žádný další přínos ve srovnání s monoterapií. Obecně se vyhněte kombinovanému užívání inhibitorů RAS. Pečlivě sledujte krevní tlak, renální funkce a elektrolyty u pacientů užívajících AVAPRO 150 mg a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s přípravkem AVAPRO pacientům s diabetem. Vyhněte se použití aliskirenu s přípravkem AVAPRO u pacientů s poruchou funkce ledvin (GFR
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.
OPATŘENÍ
Fetální toxicita
AVAPRO 150 mg může způsobit poškození plodu při podání těhotné ženě. Užívání léků, které působí na reninangiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Když je zjištěno těhotenství, přerušte co nejdříve AVAPRO [viz Použití u konkrétních populací ].
Hypotenze u pacientů se sníženým objemem nebo solí
U pacientů s aktivovaným systémem renin-angiotenzin, jako jsou pacienti s deplecí objemu nebo solí (např. pacienti léčení vysokými dávkami diuretik), se po zahájení léčby přípravkem AVAPRO může objevit symptomatická hypotenze. Upravte depleci objemu nebo soli před podáním AVAPRO 300 mg nebo použijte nižší počáteční dávku (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Porucha funkce ledvin
Změny renálních funkcí včetně akutního renálního selhání mohou být způsobeny léky, které inhibují renin-angiotensinový systém. Pacienti, jejichž funkce ledvin může částečně záviset na aktivitě systému renin-angiotenzin (např. pacienti se stenózou renální arterie, chronickým onemocněním ledvin, těžkým srdečním selháním nebo objemovou deplecí), mohou mít zvláštní riziko rozvoje akutního selhání ledvin nebo smrti na AVAPRO. U těchto pacientů pravidelně sledujte renální funkce. Zvažte pozastavení nebo přerušení léčby u pacientů, u kterých dojde ke klinicky významnému snížení renálních funkcí na AVAPRO (viz DROGOVÉ INTERAKCE ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebyly pozorovány žádné známky karcinogenity při podávání irbesartanu v dávkách až 500/1000 mg/kg/den (samci/samice) u potkanů a 1000 mg/kg/den u myší po dobu až 2 let. U samců a samic potkanů poskytla dávka 500 mg/kg/den průměrnou systémovou expozici irbesartanu (AUC 0 – 24 hodin, vázaný plus nevázaný) asi 3krát a 11krát, v tomto pořadí, než je průměrná systémová expozice u lidí, kteří dostávali maximální doporučenou dávku pro člověka. dávka (MRHD) 300 mg irbesartanu/den, zatímco dávka 1000 mg/kg/den (podávaná pouze ženám) poskytla průměrnou systémovou expozici asi 21krát vyšší, než byla u lidí hlášena při MRHD. U myších samců a samic poskytla dávka 1000 mg/kg/den expozici irbesartanu asi 3krát a 5krát vyšší, než je expozice u člověka při dávce 300 mg/den.
Irbesartan nebyl mutagenní v řadě testů in vitro (Amesův mikrobiální test, test opravy DNA hepatocytů potkana, V79 test forward genové mutace savčích buněk). Irbesartan byl negativní v několika testech na indukci chromozomálních aberací (in vitro – test na lidských lymfocytech; in vivo – studie mikrojader myší).
Irbesartan neměl žádné nežádoucí účinky na fertilitu nebo páření samců nebo samic potkanů při perorálních dávkách ≤ 650 mg/kg/den, přičemž nejvyšší dávka poskytuje systémovou expozici irbesartanu (AUC 0 – 24 hodin, vázaná plus nevázaná) asi 5krát vyšší nalezený u lidí, kteří dostávají MRHD 300 mg/den.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
AVAPRO může způsobit poškození plodu při podání těhotné ženě. Užívání léků, které působí na reninangiotensinový systém během druhého a třetího trimestru těhotenství snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí [viz Klinické úvahy ]. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenzivum v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv. Při zjištění těhotenství přerušte léčbu přípravkem AVAPRO 150 mg co nejdříve.
Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků bez ohledu na expozici léku. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 % až 4 % a 15 % až 20 %.
Klinické úvahy
Mateřské a/nebo embryo-fetální riziko spojené s nemocí
Hypertenze v těhotenství zvyšuje u matky riziko preeklampsie, gestačního diabetu, předčasného porodu a porodních komplikací (např. nutnost císařského řezu a poporodní krvácení). Hypertenze zvyšuje riziko fetálního omezení intrauterinního růstu a intrauterinní smrti. Těhotné ženy s hypertenzí by měly být pečlivě sledovány a odpovídajícím způsobem léčeny.
Fetální/neonatální nežádoucí reakce

Oligohydramnion u těhotných žen, které užívají léky ovlivňující renin-angiotensinový systém ve druhém a třetím trimestru těhotenství, může mít za následek: sníženou funkci ledvin plodu vedoucí k anurii a selhání ledvin, hypoplazii plic plodu, deformace skeletu, včetně hypoplazie lebky, hypotenzi a smrt.
V neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativa k léčbě léky ovlivňujícími renin-angiotensinový systém, informujte matku o potenciálním riziku pro plod.
Proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. V závislosti na týdnu těhotenství může být vhodné provést fetální testování. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění. Pokud je pozorován oligohydramnion, zvažte alternativní léčbu. Pečlivě sledujte kojence s anamnézou expozice přípravku AVAPRO in utero kvůli hypotenzi, oligurii a hyperkalémii a dalším příznakům poškození ledvin. U novorozenců s anamnézou in utero expozice AVAPRO 300 mg, pokud se objeví oligurie nebo hypotenze, zaměřit pozornost na podporu krevního tlaku a renální perfuze. Může být zapotřebí výměnná transfuze nebo dialýza jako prostředek ke zvrácení hypotenze a/nebo náhradě poruchy funkce ledvin.
Data
Údaje o zvířatech
Irbesartan prochází placentou u potkanů a králíků. U samic potkanů, kterým byl před pářením během březosti a laktace podáván irbesartan v perorálních dávkách 50, 180 nebo 650 mg/kg/den (1,6 až 21,1násobek maximální doporučené dávky pro člověka (MRHD) na základě plochy povrchu těla), byly plody vyšetřeny na 20. den gestace ukázal zvýšený výskyt kavitace hydroureteru a ledvinové pánvičky a/nebo nepřítomnost renální papily ve všech skupinách léčených irbesartanem. Subkutánní edém se také objevil u plodů při dávkách matek ≥180 mg/kg/den (5,8násobek MRHD). Tyto anomálie se vyskytly, když samice potkanů dostávaly irbesartan od před pářením do 20. dne březosti, ale nebyly pozorovány u mláďat postnatálně ve stejné studii, nebo když byl irbesartan podáván březím potkanům pouze během organogeneze (den 6. do 15. dne březosti) v perorální dávky od 50 do 450 mg/kg/den (až 14,6násobek MRHD). Kromě toho nebyly pozorovány žádné nežádoucí účinky na vývoj ledvin u mláďat samic, kterým byl irbesartan podáván od 15. dne březosti do 24. dne laktace v dávkách 50, 180 nebo 650 mg/kg/den (až 21,1násobek MRHD). Předpokládá se, že pozorované účinky jsou pozdními gestačními účinky léku. Březí králice, kterým byly perorálně podávány dávky irbesartanu 30 mg/kg/den (1,9násobek MRHD na základě tělesného povrchu), zaznamenaly vysokou úmrtnost matek a potratů. Přežívající samice měly mírný nárůst časných resorpcí a odpovídající pokles živých plodů.
Radioaktivita byla přítomna u plodů potkanů a králíků během pozdní březosti po perorálních dávkách radioaktivně značeného irbesartanu.
Laktace
Nejsou k dispozici žádné údaje o přítomnosti irbesartanu v mateřském mléce, účincích na produkci mléka nebo na kojené dítě. Irbesartan nebo některý metabolit irbesartanu je vylučován do mléka kojících potkanů (viz KLINICKÁ FARMAKOLOGIE ]. Vzhledem k potenciálu nežádoucích účinků na kojené dítě se použití přípravku AVAPRO 150 mg u kojících žen nedoporučuje.
Pediatrické použití
Irbesartan ve studii v dávce až 4,5 mg/kg/den jednou denně neprokázal účinné snížení krevního tlaku u pediatrických pacientů ve věku 6 až 16 let.
AVAPRO nebyl studován u pediatrických pacientů mladších 6 let.
Geriatrické použití
Ze 4 925 subjektů užívajících AVAPRO v kontrolovaných klinických studiích hypertenze bylo 911 (18,5 %) ve věku 65 let a více, zatímco 150 (3,0 %) bylo ve věku 75 let a více. Mezi těmito subjekty a mladšími subjekty nebyly pozorovány žádné celkové rozdíly v účinnosti nebo bezpečnosti, nelze však vyloučit větší citlivost některých starších jedinců. [Vidět KLINICKÁ FARMAKOLOGIE a Klinické studie ]
PŘEDÁVKOVAT
Nejsou k dispozici žádné údaje o předávkování u lidí. Nicméně denní dávky 900 mg po dobu 8 týdnů byly dobře tolerovány. Očekává se, že nejpravděpodobnějšími projevy předávkování jsou hypotenze a tachykardie; bradykardie se také může objevit z předávkování. Irbesartan nelze odstranit hemodialýzou.
Studie akutní perorální toxicity s irbesartanem u myší a potkanů ukázaly, že akutní letální dávky byly vyšší než 2000 mg/kg, což je asi 25násobek a 50násobek MRHD (300 mg) na základě tělesného povrchu.
KONTRAINDIKACE
AVAPRO 150 mg je kontraindikován u pacientů s přecitlivělostí na kteroukoli složku tohoto přípravku.
Nepodávejte aliskiren současně s přípravkem AVAPRO 300 mg pacientům s diabetem.
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Angiotensin II je silný vazokonstriktor tvořený z angiotensinu I reakcí katalyzovanou enzymem konvertujícím angiotenzin (ACE, kinináza II). Angiotenzin II je primárním vazoaktivním hormonem reninangiotensinového systému a důležitou složkou v patofyziologii hypertenze. Stimuluje také sekreci aldosteronu kůrou nadledvin. Irbesartan blokuje vazokonstrikční a aldosteron vylučující účinky angiotensinu II selektivní vazbou na AT1 receptor angiotenzinu II, který se nachází v mnoha tkáních (např. hladké svalstvo cév, nadledvinka). V mnoha tkáních je také receptor AT2, ale nepodílí se na kardiovaskulární homeostáze.
Irbesartan je specifický kompetitivní antagonista receptorů AT1 s mnohem větší afinitou (více než 8500krát) k receptoru AT1 než k receptoru AT2 a bez agonistické aktivity.
Blokáda receptoru AT1 odstraňuje negativní zpětnou vazbu angiotenzinu II na sekreci reninu, ale výsledná zvýšená aktivita plazmatického reninu a cirkulující angiotenzin II nepřekonají účinky irbesartanu na krevní tlak.
Irbesartan neinhibuje ACE nebo renin ani neovlivňuje jiné hormonální receptory nebo iontové kanály, o kterých je známo, že se podílejí na kardiovaskulární regulaci krevního tlaku a homeostáze sodíku.
Farmakodynamika
U zdravých subjektů vyvolaly jednotlivé perorální dávky irbesartanu až 300 mg na dávce závislou inhibici presorického účinku infuzí angiotensinu II. Inhibice byla úplná (100 %) 4 hodiny po perorálních dávkách 150 mg nebo 300 mg a částečná inhibice trvala 24 hodin (60 % a 40 % při 300 mg a 150 mg, v daném pořadí).
pacientů s hypertenzí způsobuje inhibice receptoru angiotenzinu II po chronickém podávání irbesartanu 1,5- až 2-násobné zvýšení plazmatické koncentrace angiotenzinu II a 2- až 3-násobné zvýšení plazmatických hladin reninu. Plazmatické koncentrace aldosteronu po podání irbesartanu obecně klesají, ale hladiny draslíku v séru nejsou při doporučených dávkách významně ovlivněny.
U hypertoniků neměly chronické perorální dávky irbesartanu (až 300 mg) žádný vliv na rychlost glomerulární filtrace, renální průtok plazmy nebo filtrační frakci. Ve studiích s opakovanými dávkami u pacientů s hypertenzí nebyly pozorovány žádné klinicky významné účinky na koncentrace triglyceridů nalačno, celkového cholesterolu nebo HDL-cholesterolu. Během chronického perorálního podávání nebyl zjištěn žádný účinek na sérovou kyselinu močovou a žádný urikosurický účinek.
Farmakokinetika
Vstřebávání
Perorální absorpce irbesartanu je rychlá a úplná s průměrnou absolutní biologickou dostupností 60 % až 80 %. Po perorálním podání AVAPRO je maximálních plazmatických koncentrací irbesartanu dosaženo za 1,5 až 2 hodiny po podání. Jídlo neovlivňuje biologickou dostupnost irbesartanu.
Irbesartan vykazuje lineární farmakokinetiku v rozmezí terapeutických dávek.
Rozdělení
Irbesartan se z 90 % váže na sérové proteiny (především albumin a α-kyselý glykoprotein) se zanedbatelnou vazbou na buněčné složky krve. Průměrný distribuční objem je 53 až 93 litrů.
Studie na zvířatech ukazují, že radioaktivně značený irbesartan slabě prochází hematoencefalickou bariérou a placentou. Irbesartan se vylučuje do mléka kojících potkanů.
Odstranění
Celková plazmatická a renální clearance jsou v rozmezí 157 až 176 ml/min, respektive 3,0 až 3,5 ml/min. Terminální eliminační poločas irbesartanu je v průměru 11 až 15 hodin. Ustálené koncentrace je dosaženo do 3 dnů. Omezená akumulace irbesartanu (
Metabolismus
Irbesartan je perorálně účinná látka, která nevyžaduje biotransformaci do aktivní formy. Irbesartan je metabolizován glukuronidovou konjugací a oxidací. Po perorálním nebo intravenózním podání značeného irbesartanu lze více než 80 % cirkulující plazmatické radioaktivity připsat nezměněnému irbesartanu. Primárním cirkulujícím metabolitem je inaktivní konjugát irbesartan-glukuronid (přibližně 6 %). Zbývající oxidační metabolity se významně nepřidávají k farmakologické aktivitě irbesartanu.
Studie in vitro ukazují, že irbesartan je oxidován primárně CYP2C9; metabolismus CYP3A4 je zanedbatelný.
Vylučování
Irbesartan a jeho metabolity jsou vylučovány žlučí i ledvinami. Po perorálním nebo intravenózním podání irbesartanu značeného 14C se asi 20 % radioaktivity objeví v moči a zbytek ve stolici, jako irbesartan nebo irbesartan glukuronid.
Specifické populace
Sex
Žádné rozdíly ve farmakokinetice související s pohlavím nebyly pozorovány u zdravých starších osob (ve věku 65 – 80 let) nebo u zdravých mladých subjektů (ve věku 18 – 40 let). Ve studiích u pacientů s hypertenzí nebyl zjištěn žádný rozdíl mezi pohlavími v poločasu rozpadu nebo akumulaci, ale u žen byly pozorovány poněkud vyšší plazmatické koncentrace irbesartanu (11 % – 44 %). Není nutná žádná úprava dávkování v závislosti na pohlaví.
Geriatrie
starších subjektů (ve věku 65 – 80 let) není poločas eliminace irbesartanu významně změněn, ale hodnoty AUC a Cmax jsou asi o 20 % až 50 % vyšší než u mladých subjektů (věk 18 – 40 let). U starších pacientů není nutná žádná úprava dávkování.
Rasa/etnická příslušnost
U zdravých jedinců černé pleti jsou hodnoty AUC irbesartanu přibližně o 25 % vyšší než u bělochů; není žádný rozdíl v hodnotách Cmax.
Renální poškození
Farmakokinetika irbesartanu se nemění u pacientů s poruchou funkce ledvin nebo u pacientů na hemodialýze. Irbesartan nelze odstranit hemodialýzou. U pacientů s mírnou až těžkou poruchou funkce ledvin není nutná žádná úprava dávkování, pokud pacient s poruchou funkce ledvin nemá také depleci objemu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ].
Jaterní nedostatečnost
Farmakokinetika irbesartanu po opakovaném perorálním podání není významně ovlivněna u pacientů s mírnou až středně těžkou cirhózou jater. U pacientů s jaterní insuficiencí není nutná žádná úprava dávkování.
Lékové interakce
Studie in vitro ukazují významnou inhibici tvorby oxidovaných metabolitů irbesartanu se známými substráty/inhibitory cytochromu CYP2C9 sulfenazolem, tolbutamidem a nifedipinem. V klinických studiích však byly důsledky současného podávání irbesartanu na farmakodynamiku warfarinu zanedbatelné. Na základě údajů in vitro se neočekává žádná interakce s léky, jejichž metabolismus je závislý na izoenzymech 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 nebo 3A4 cytochromu P450.
V samostatných studiích u pacientů užívajících udržovací dávky warfarinu, hydrochlorothiazidu nebo digoxinu nemělo podávání irbesartanu po dobu 7 dnů žádný vliv na farmakodynamiku warfarinu (protrombinový čas) nebo farmakokinetiku digoxinu. Farmakokinetika irbesartanu není ovlivněna současným podáváním nifedipinu nebo hydrochlorothiazidu.
Klinické studie
Hypertenze
Antihypertenzní účinky přípravku AVAPRO byly zkoumány v 7 placebem kontrolovaných 8- až 12týdenních studiích u pacientů s výchozím diastolickým krevním tlakem 95 až 110 mmHg. Do těchto studií byly zahrnuty dávky 1 až 900 mg, aby bylo možné plně prozkoumat rozsah dávek irbesartanu. Tyto studie umožnily srovnání režimů jednou nebo dvakrát denně při dávce 150 mg/den, srovnání maximálních a nejnižších účinků a srovnání odezvy podle pohlaví, věku a rasy. Dvě ze sedmi placebem kontrolovaných studií uvedených výše zkoumaly antihypertenzní účinky irbesartanu a hydrochlorothiazidu v kombinaci.
studií monoterapie irbesartanem zahrnovalo celkem 1 915 pacientů randomizovaných na irbesartan (1 – 900 mg) a 611 pacientů randomizovaných na placebo. Dávky 150 mg a 300 mg podávané jednou denně poskytly statisticky a klinicky významné snížení systolického a diastolického krevního tlaku s minimálními účinky (24 hodin po dávce) po 6 až 12 týdnech léčby ve srovnání s placebem, přibližně o 8 – 10/ 5 – 6 mmHg a 8 – 12/5 – 8 mmHg, v tomto pořadí. Žádné další zvýšení účinku nebylo pozorováno při dávkách vyšších než 300 mg. Vztahy mezi dávkou a odezvou pro účinky na systolický a diastolický tlak jsou znázorněny na obrázcích 1 a 2.
Obrázek 1: Placebem odečtené snížení minimální hladiny SeSBP; integrovaná analýza
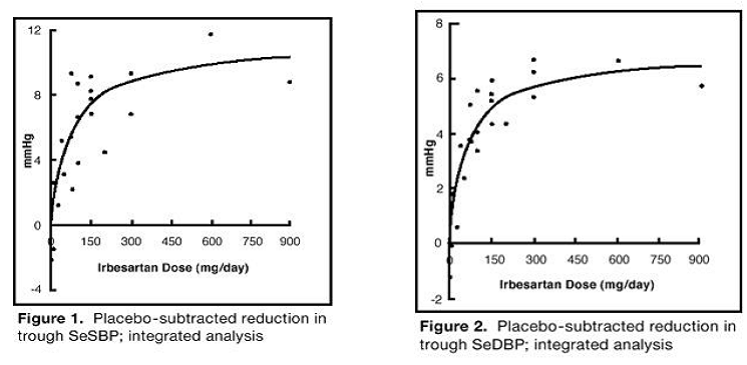
Obrázek 2: Placebem odečtené snížení hladiny SeSBP; integrovaná analýza
Podání terapeutických dávek irbesartanu jednou denně přineslo vrcholné účinky přibližně za 3 až 6 hodin a v jedné ambulantní studii monitorování krevního tlaku opět za přibližně 14 hodin. To bylo pozorováno při dávkování jednou denně i dvakrát denně. Poměry mezi nejnižší a nejvyšší hodnotou pro systolickou a diastolickou odpověď byly obecně mezi 60 % a 70 %. V kontinuální ambulantní studii monitorování krevního tlaku poskytovalo dávkování 150 mg jednou denně minimální a průměrnou 24hodinovou odpověď podobnou těm, které byly pozorovány u pacientů, kteří dostávali stejnou celkovou denní dávku dvakrát denně.
V kontrolovaných studiích vedlo přidání irbesartanu k hydrochlorothiazidu v dávkách 6,25 mg, 12,5 mg nebo 25 mg k dalšímu na dávce závislému snížení krevního tlaku podobnému snížení dosaženému při stejné dávce irbesartanu v monoterapii. HCTZ měl také přibližně aditivní účinek.
Analýza věkových, pohlaví a rasových podskupin pacientů ukázala, že muži a ženy a pacienti starší a mladší 65 let měli obecně podobné odpovědi. Irbesartan byl účinný při snižování krevního tlaku bez ohledu na rasu, i když u černochů (obvykle populace s nízkým obsahem reninu) byl účinek poněkud menší.
Účinek irbesartanu je patrný po první dávce a blíží se jeho plnému pozorovanému účinku po 2 týdnech. Na konci 8týdenní expozice byly asi 2/3 antihypertenzního účinku stále přítomny týden po poslední dávce. Rebound hypertenze nebyla pozorována. U pacientů léčených irbesartanem v kontrolovaných studiích nedošlo v podstatě k žádné změně průměrné srdeční frekvence.
Nefropatie u pacientů s diabetem 2. typu
Irbesartan Diabetic Nephropathy Trial (IDNT) byla randomizovaná, placebem a aktivní látkou kontrolovaná, dvojitě zaslepená, multicentrická studie provedená po celém světě u 1715 pacientů s diabetem 2. typu, hypertenzí (SeSBP >135 mmHg nebo SeDBP >85 mmHg) a nefropatií (sérové kreatinin 1,0 až 3,0 mg/dl u žen nebo 1,2 až 3,0 mg/dl u mužů a proteinurie ≥ 900 mg/den). Pacienti byli randomizováni tak, aby dostávali AVAPRO 75 mg, amlodipin 2,5 mg nebo odpovídající placebo jednou denně. Pacienti byli titrováni na udržovací dávku AVAPRO 300 mg nebo amlodipin 10 mg podle tolerance. Další antihypertenziva (kromě ACE inhibitorů, antagonistů receptoru angiotenzinu II a blokátorů kalciových kanálů) byla přidána podle potřeby k dosažení cílového krevního tlaku (≤135/85 nebo 10 mmHg snížení systolického krevního tlaku, pokud je vyšší než 160 mmHg) u pacientů ve všech skupinách .
Populace studie tvořili 66,5 % muži, 72,9 % mladší 65 let a 72 % běloši (obyvatelé Asie/Pacifiku 5,0 %, černoši 13,3 %, hispánci 4,8 %). Průměrný výchozí systolický a diastolický krevní tlak byl 159 mmHg a 87 mmHg. Pacienti vstoupili do studie s průměrnou hodnotou sérového kreatininu 1,7 mg/dl a průměrnou proteinurií 4144 mg/den.
Průměrný dosažený krevní tlak byl 142/77 mmHg pro AVAPRO, 142/76 mmHg pro amlodipin a 145/79 mmHg pro placebo. Celkově 83,0 % pacientů dostávalo cílovou dávku irbesartanu více než 50 % případů. Pacienti byli sledováni po průměrnou dobu 2,6 roku.
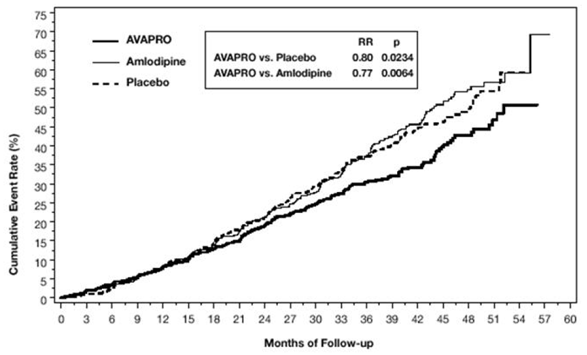
Primárním složeným cílovým parametrem byla doba do výskytu kterékoli z následujících příhod: zdvojnásobení výchozích hodnot sérového kreatininu, terminální onemocnění ledvin (ESRD; definované sérovým kreatininem ≥6 mg/dl, dialýza nebo transplantace ledvin) nebo úmrtí . Léčba přípravkem AVAPRO 150 mg vedla k 20% snížení rizika oproti placebu (p=0,0234) (viz obrázek 3 a tabulka 1). Léčba přípravkem AVAPRO 150 mg také snížila výskyt trvalého zdvojnásobení sérového kreatininu jako samostatného cílového parametru (33 %), ale neměla žádný významný účinek na samotnou ESRD a neměla žádný vliv na celkovou mortalitu (viz tabulka 1).
Obrázek 3: IDNT: Kaplan-Meierovy odhady primárního koncového bodu (zdvojnásobení sérového kreatininu, konečné stadium onemocnění ledvin nebo mortalita ze všech příčin)
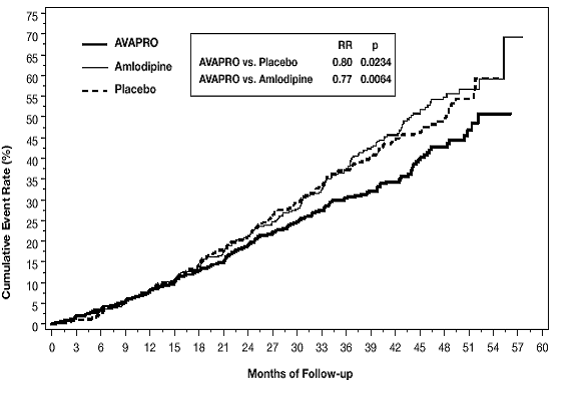
Procentní podíly pacientů, u kterých se během studie vyskytla příhoda, lze vidět v tabulce 1 níže:
Sekundárním cílovým parametrem studie byl kompozit kardiovaskulární mortality a morbidity (infarkt myokardu, hospitalizace pro srdeční selhání, cévní mozková příhoda s trvalým neurologickým deficitem, amputace). V těchto koncových bodech nebyly mezi léčebnými skupinami žádné statisticky významné rozdíly. Ve srovnání s placebem AVAPRO 150 mg významně snížilo proteinurii asi o 27 %, což je účinek, který byl patrný do 3 měsíců od zahájení léčby. AVAPRO signifikantně snížilo rychlost ztráty funkce ledvin (glomerulární filtrace), měřeno převrácenou hodnotou koncentrace kreatininu v séru, o 18,2 %.
Tabulka 2 uvádí výsledky pro demografické podskupiny. Analýzy podskupin je obtížné interpretovat a není známo, zda tato pozorování představují skutečné rozdíly nebo náhodné účinky. Pro primární cíl byly příznivé účinky přípravku AVAPRO pozorovány u pacientů užívajících také další antihypertenziva (antagonisté receptoru angiotensinu II, inhibitory angiotenzin konvertujícího enzymu a blokátory kalciových kanálů nebyly povoleny), perorální hypoglykemika a lipidy snižující látky.
INFORMACE PRO PACIENTA
Těhotenství
Informujte pacientky ve fertilním věku o důsledcích expozice AVAPRO během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Pacientky by měly být požádány, aby co nejdříve hlásily těhotenství svým lékařům.
Draslíkové doplňky
Informujte pacienty, kteří dostávají AVAPRO, aby nepoužívali doplňky draslíku nebo náhražky soli obsahující draslík bez konzultace se svým poskytovatelem zdravotní péče [viz DROGOVÉ INTERAKCE ].
