Zestoretic 5/12.5g/mg Lisinopril Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Zestoretic a jak se používá?
Zestoretic je lék na předpis používaný k léčbě příznaků hypertenze (vysokého krevního tlaku) a zadržování tekutin. Zestoretic 5 mg lze užívat samostatně nebo s jinými léky.
Není známo, zda je přípravek Zestoretic 5 mg bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Zestoretic 5 mg?
Zestoretic může způsobit závažné nežádoucí účinky, včetně:
- pocit točení hlavy,
- bolest očí nebo problémy se zrakem,
- malé nebo žádné močení,
- slabost,
- ospalost,
- pocit neklidu,
- horečka ,
- zimnice,
- bolest krku,
- vředy v ústech,
- potíže s polykáním,
- zežloutnutí kůže a očí (žloutenka),
- nevolnost,
- zvracení,
- štiplavý pocit,
- bolest na hrudi,
- nepravidelný srdeční tep nebo chvění na hrudi,
- ztráta pohybu,
- křeče v nohou,
- zácpa,
- extrémní žízeň,
- zvýšené močení,
- necitlivost nebo mravenčení,
- svalová slabost,
- bolest hlavy,
- ztráta nebo koordinace a
- pocit nejistoty
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Zestoretic patří:
- kašel
- bolest hlavy
- závrať
- cítit se unaveně
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Zestoretic. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
- Při zjištění těhotenství přerušte co nejdříve ZESTORETIC.
- Léky, které působí přímo na renin-angiotensinový systém, mohou způsobit poranění a smrt vyvíjejícího se plodu. Vidět VAROVÁNÍ Fetální toxicita.
POPIS
ZESTORETIC® (lisinopril a hydrochlorothiazid) kombinuje inhibitor angiotenzin konvertujícího enzymu lisinopril a diuretikum hydrochlorothiazid.
Lisinopril, syntetický peptidový derivát, je perorální dlouhodobě působící inhibitor enzymu konvertujícího angiotenzin. Chemicky je popsán jako dihydrát (S)-1-[N2-(1-karboxy-3-fenylpropyl)-L-lysyl]-L-prolinu. Jeho empirický vzorec je C21H31N3O5. 2H2O a jeho strukturní vzorec je:
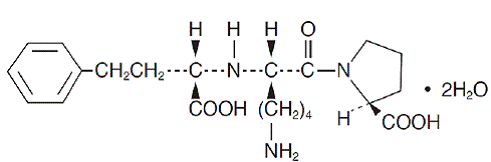
Lisinopril je bílý až téměř bílý krystalický prášek s molekulovou hmotností 441,53. Je rozpustný ve vodě, těžce rozpustný v methanolu a prakticky nerozpustný v ethanolu.
Hydrochlorothiazid je 6-chlor-3,4-dihydro-2H-l,2,4-benzothiadiazin-7-sulfonamid 1,1-dioxid. Jeho empirický vzorec je C7H8ClN3O4S2 a jeho strukturní vzorec je:
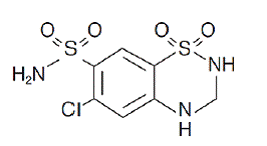
Hydrochlorothiazid je bílý nebo prakticky bílý krystalický prášek s molekulovou hmotností 297,72, který je mírně rozpustný ve vodě, ale volně rozpustný v roztoku hydroxidu sodného.
ZESTORETIC 5 mg je k dispozici pro perorální podání ve třech tabletových kombinacích lisinoprilu s hydrochlorothiazidem: ZESTORETIC 10-12,5 obsahující 10 mg lisinoprilu a 12,5 mg hydrochlorothiazidu; ZESTORETIC 20 Reference 12,5 obsahující 20 mg lisinoprilu a 12,5 mg hydrochlorothiazidu; a ZESTORETIC 20-25 obsahující 20 mg lisinoprilu a 25 mg hydrochlorothiazidu.
Neaktivní ingredience
10-12,5 tablet - fosforečnan vápenatý, stearát hořečnatý, mannitol, červený oxid železitý, kukuřičný škrob, žlutý oxid železitý.
20-12,5 tablet - fosforečnan vápenatý, stearát hořečnatý, mannitol, kukuřičný škrob.
20-25 tablet - fosforečnan vápenatý, stearát hořečnatý, mannitol, červený oxid železitý, kukuřičný škrob, žlutý oxid železitý.
INDIKACE
ZESTORETIC je indikován k léčbě hypertenze, ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko fatálních a nefatálních kardiovaskulárních příhod, především mozkových příhod a infarktů myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd včetně lisinoprilu a hydrochlorothiazidu.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než 1 lék. Konkrétní rady ohledně cílů a managementu naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak.
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu a lze dojít k závěru, že se jedná o snížení krevního tlaku a ne o některé další farmakologické vlastnosti. léky, které jsou z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika cévní mozkové příhody, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je v populacích podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů by se dalo očekávat těžit z agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie.
Tyto fixní kombinace nejsou indikovány pro úvodní terapii (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Při používání přípravku ZESTORETIC je třeba vzít v úvahu skutečnost, že inhibitor angiotenzin konvertujícího enzymu, kaptopril, způsobil agranulocytózu, zejména u pacientů s poruchou funkce ledvin nebo kolagenovým vaskulárním onemocněním, a že dostupné údaje nejsou dostatečné k prokázání, že lisinopril nemá podobné riziko (viz VAROVÁNÍ ).
Při zvažování použití přípravku ZESTORETIC mg je třeba poznamenat, že ACE inhibitory byly spojeny s vyšším výskytem angioedému u černochů než u pacientů jiné rasy (viz VAROVÁNÍ , Lisinopril ).
DÁVKOVÁNÍ A PODÁVÁNÍ
Monoterapie lisinoprilem je účinná léčba hypertenze v dávkách 10 mg až 80 mg jednou denně, zatímco monoterapie hydrochlorothiazidem je účinná v dávkách 12,5 mg denně až 50 mg denně. V klinických studiích kombinované léčby lisinoprilem/hydrochlorothiazidem s použitím lisinoprilu v dávkách 10 mg až 80 mg a hydrochlorothiazidu v dávkách 6,25 mg až 50 mg se míra antihypertenzní odpovědi obecně zvyšovala se zvyšující se dávkou kterékoli složky.
Vedlejší účinky (viz VAROVÁNÍ ) lisinoprilu jsou obecně vzácné a zjevně nezávislé na dávce; ty hydrochlorothiazidu jsou směsí jevů závislých na dávce (především hypokalémie) a jevů nezávislých na dávce (např. pankreatitida), přičemž první z nich je mnohem častější než druhý. Léčba jakoukoli kombinací lisinoprilu a hydrochlorothiazidu může být spojena s jedním nebo oběma vedlejšími účinky nezávislými na dávce nebo závislými na dávce, ale přidání lisinoprilu v klinických studiích zmírnilo hypokalemii běžně pozorovanou u diuretik.
Pro minimalizaci vedlejších účinků závislých na dávce je obvykle vhodné zahájit kombinovanou léčbu až poté, co se u pacienta nepodařilo dosáhnout požadovaného účinku monoterapií.
Titrace dávky řízená klinickým účinkem
Pacient, jehož krevní tlak není dostatečně kontrolován monoterapií lisinoprilem nebo hydrochlorothiazidem, může být převeden na lisinopril/HCTZ 10/12,5 nebo lisinopril/HCTZ 20/12,5 v závislosti na aktuální dávce monoterapie. Další zvýšení jedné nebo obou složek by mělo záviset na klinické odpovědi s krevním tlakem měřeným v intervalu mezi jednotlivými dávkami, aby se zajistilo, že v té době je adekvátní antihypertenzní účinek. Dávka hydrochlorothiazidu by se obecně neměla zvyšovat, dokud neuplynou 2 až 3 týdny. Po přidání diuretika může být možné snížit dávku lisinoprilu. Pacienti, jejichž krevní tlak je adekvátně kontrolován denní dávkou 25 mg hydrochlorothiazidu, ale u kterých dochází k významné ztrátě draslíku při tomto režimu, mohou dosáhnout podobné nebo vyšší kontroly krevního tlaku bez poruch elektrolytů, pokud přejdou na lisinopril/HCTZ 10/12,5.
pacientů, kteří jsou v současné době léčeni diuretiky, se po úvodní dávce lisinoprilu může příležitostně objevit symptomatická hypotenze. Diuretikum by mělo být pokud možno vysazeno na dva až tři dny před zahájením léčby lisinoprilem, aby se snížila pravděpodobnost hypotenze (viz VAROVÁNÍ ). Pokud není krevní tlak pacienta kontrolován samotným lisinoprilem, může být léčba diuretiky obnovena.
Pokud nelze diuretikum vysadit, měla by se pod lékařským dohledem užívat úvodní dávka 5 mg lisinoprilu po dobu nejméně dvou hodin a dokud se krevní tlak nestabilizuje po dobu nejméně další hodiny (viz VAROVÁNÍ a OPATŘENÍ , DROGOVÉ INTERAKCE ).
Současné podávání přípravku ZESTORETIC s doplňky draslíku, náhradami draslíkové soli nebo draslík šetřícími diuretiky může vést ke zvýšení sérového draslíku (viz OPATŘENÍ ).
Substituční terapie
Kombinace může být nahrazena titrovanými jednotlivými složkami.
Použití při poškození ledvin
Režimy léčby lisinoprilem/HCTZ nemusí brát v úvahu renální funkce, pokud je clearance kreatininu pacienta >30 ml/min/1,7 m2 (sérový kreatinin přibližně ≤3 mg/dl nebo 265 μmol/l). U pacientů se závažnějším poškozením ledvin jsou kličková diuretika preferována před thiazidy, proto se lisinopril/HCTZ nedoporučuje (viz VAROVÁNÍ , Anafylaktoidní reakce během expozice membrány ).
JAK DODÁVÁNO
ZESTORETIC 10-12,5 tablety: Broskvové, kulaté, bikonvexní, nepotahované tablety označené „141“ vyraženým na jedné straně a „ZESTORETIC“ na druhé straně se dodávají v lahvičkách po 90 tabletách ( NDC 52427-435-90) a lahvičky po 100 tabletách ( NDC 52427-435-01).
ZESTORETIC 20-12,5 tablety : Bílé, kulaté, bikonvexní, nepotahované tablety označené „142“ vyraženým na jedné straně a „ZESTORETIC“ na druhé straně jsou dodávány v lahvičkách po 90 tabletách ( NDC 52427-436-90) a lahvičky po 100 tabletách ( NDC 52427-436-01).
ZESTORETIC 20-25 tablet Broskvové, kulaté, bikonvexní, nepotahované tablety označené „145“ vyraženým na jedné straně a „ZESTORETIC“ na druhé straně jsou dodávány v lahvičkách po 90 tabletách ( NDC 52427-43790) a lahvičky po 100 tabletách ( NDC 52427-437-01).
Úložný prostor
Skladujte při kontrolované pokojové teplotě, 20-25 °C (68-77 °F) [viz USP]. Chraňte před nadměrným světlem a vlhkostí.
Distribuce: Almatica Pharma, Inc. Pine Brook, NJ 07058 USA. Revize: červenec 2017.
VEDLEJŠÍ EFEKTY
Bezpečnost ZESTORETIC 12,5 mg byla hodnocena u 930 pacientů včetně 100 pacientů léčených po dobu 50 týdnů nebo déle.
V klinických studiích s přípravkem ZESTORETIC nebyly pozorovány žádné nežádoucí účinky typické pro tento kombinovaný lék. Nežádoucí účinky, které se vyskytly, byly omezeny na ty, které byly dříve hlášeny u lisinoprilu nebo hydrochlorothiazidu.
Nejčastější klinické nežádoucí účinky v kontrolovaných studiích (včetně otevřených prodloužených) s jakoukoli kombinací lisinoprilu a hydrochlorothiazidu byly: závratě (7,5 %), bolest hlavy (5,2 %), kašel (3,9 %), únava (3,7 %) a ortostatické účinky (3,2 %), z nichž všechny byly častější než u pacientů léčených placebem. Obecně byly nežádoucí účinky mírné a přechodné povahy, ale viz VAROVÁNÍ týkající se angioedému a nadměrné hypotenze nebo synkopy. Přerušení léčby z důvodu nežádoucích účinků bylo nutné u 4,4 % pacientů především pro závratě, kašel, únavu a svalové křeče.
Nežádoucí účinky vyskytující se u více než jednoho procenta pacientů léčených lisinoprilem a hydrochlorothiazidem v kontrolovaných klinických studiích jsou uvedeny níže.
Procento pacientů v kontrolovaných studiích
Klinické nežádoucí účinky vyskytující se u 0,3 % až 1,0 % pacientů v kontrolovaných studiích a vzácnější, závažné, možná s lékem související příhody hlášené v marketingových zkušenostech jsou uvedeny níže:
Tělo jako celek: Bolest na hrudi, bolest břicha, synkopa, nepohodlí na hrudi, horečka, trauma, virová infekce. Kardiovaskulární: Palpitace, ortostatická hypotenze. Zažívací: Gastrointestinální křeče, sucho v ústech, zácpa, pálení žáhy. Muskuloskeletální: Bolesti zad, ramen, kolen, namožení zad, myalgie, bolesti nohou. Nervové/psychiatrické: Snížené libido, vertigo, deprese, somnolence. Respirační: Běžné nachlazení, ucpaný nos, chřipka, bronchitida, faryngální bolest, dušnost, plicní kongesce, chronická sinusitida, alergická rýma, faryngální dyskomfort. Kůže: Zrudnutí, svědění, zánět kůže, pocení, kožní pseudolymfom. Speciální smysly: Rozmazané vidění, tinnitus, otalgie. Urogenitální: Infekce močových cest.
Angioedém: Byl hlášen angioedém obličeje, končetin, rtů, jazyka, glottis a/nebo hrtanu (viz VAROVÁNÍ ).
Ve vzácných případech byl po uvedení přípravku na trh hlášen střevní angioedém.
Hypotenze: V klinických studiích se nežádoucí účinky související s hypotenzí vyskytly následovně: hypotenze (1,4 %), ortostatická hypotenze (0,5 %), jiné ortostatické účinky (3,2 %). Kromě toho se synkopa objevila u 0,8 % pacientů (viz VAROVÁNÍ ).
Kašel: Vidět OPATŘENÍ - Kašel .
Výsledky klinických laboratorních testů
Sérové elektrolyty
(Vidět OPATŘENÍ ).
Kreatinin, dusík močoviny v krvi
U pacientů s esenciální hypertenzí léčených přípravkem ZESTORETIC bylo pozorováno mírné reverzibilní zvýšení dusíku močoviny v krvi a sérového kreatininu. Výraznější zvýšení bylo také hlášeno a bylo pravděpodobnější u pacientů se stenózou renální artérie (viz OPATŘENÍ ).
Sérum kyselina močová, glukóza, hořčík, cholesterol, triglyceridy a vápník
(Vidět OPATŘENÍ ).
Hemoglobin a hematokrit
pacientů s hypertenzí léčených přípravkem ZESTORETIC 5 mg se často vyskytovalo malé snížení hemoglobinu a hematokritu (průměrné snížení přibližně o 0,5 g% a 1,5 obj. %), ale mělo klinický význam vzácně, pokud se nevyskytla současně jiná příčina anémie. V klinických studiích přerušilo léčbu kvůli anémii 0,4 % pacientů.
Testy jaterních funkcí
Vzácně se vyskytlo zvýšení jaterních enzymů a/nebo sérového bilirubinu. (Vidět VAROVÁNÍ , Jaterní selhání ).
Další nežádoucí účinky, které byly hlášeny u jednotlivých složek, jsou uvedeny níže:
Lisinopril
V klinických studiích byly nežádoucí účinky, které se vyskytly u lisinoprilu, pozorovány také u přípravku ZESTORETIC. Kromě toho, a protože lisinopril byl uveden na trh, byly u lisinoprilu hlášeny následující nežádoucí účinky, které je třeba považovat za potenciální nežádoucí účinky přípravku ZESTORETIC: Tělo jako celek: Anafylaktoidní reakce (viz VAROVÁNÍ , Anafylaktoidní reakce během expozice membrány ), malátnost, edém, otok obličeje, bolest, bolest pánve, bolest v boku, zimnici; Kardiovaskulární: Srdeční zástava, infarkt myokardu nebo cerebrovaskulární příhoda, pravděpodobně sekundární k nadměrné hypotenzi u vysoce rizikových pacientů (viz VAROVÁNÍ , Hypotenze ), plicní embolie a infarkt, zhoršení srdečního selhání, arytmie (včetně tachykardie, ventrikulární tachykardie, síňové tachykardie, fibrilace síní, bradykardie a předčasných komorových kontrakcí), angina pectoris, přechodné ischemické ataky, paroxysmální noční krevní tlak, periferní dušnost, edém, vaskulitida; Zažívací: Pankreatitida, hepatitida (hepatocelulární nebo cholestatická žloutenka) (viz VAROVÁNÍ , Jaterní selhání ), gastritida, anorexie, plynatost, zvýšené slinění; Endokrinní: Diabetes mellitus, nepřiměřená sekrece antidiuretického hormonu; Hematologické: Byly hlášeny vzácné případy útlumu kostní dřeně, hemolytické anémie, leukopenie/neutropenie a trombocytopenie, u kterých nelze vyloučit kauzální vztah k lisinoprilu; Metabolické: Dna, hubnutí, dehydratace, přetížení tekutinami, přibývání na váze; Muskuloskeletální: Artritida, artralgie, bolest krku, bolest kyčle, bolest kloubů, bolest nohou, bolest paží, lumbago; Nervový systém/psychiatrický: Ataxie, zhoršení paměti, třes, nespavost, mrtvice, nervozita, zmatenost, periferní neuropatie (např. parestézie, dysestézie), křeče, hypersomnie, podrážděnost; změny nálady (včetně symptomů deprese); halucinace; Respirační: Zhoubné plicní novotvary, hemoptýza, plicní edém, plicní infiltráty, bronchospasmus, astma, pleurální výpotek, pneumonie, eozinofilní pneumonitida, sípání, ortopnoe, bolestivé dýchání, epistaxe, laryngitida, sinusitida, zánět hrtanu, zánět hltanu, revma Kůže: Kopřivka, alopecie, pásový opar, fotosenzitivita, kožní léze, kožní infekce, pemfigus, erytém, psoriáza, vzácné případy jiných závažných kožních reakcí, včetně toxické epidermální nekrolýzy a Stevens-Johnsonova syndromu (příčinná souvislost nebyla stanovena); Speciální smysly: Ztráta zraku, diplopie, fotofobie, změny chuti, poruchy čichu; Urogenitální: Akutní selhání ledvin, oligurie, anurie, urémie, progresivní azotémie, renální dysfunkce (viz OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ), pyelonefritida, dysurie, bolest prsou.
Smíšený
Byl hlášen komplex symptomů, který může zahrnovat pozitivní ANA, zvýšenou sedimentaci erytrocytů, artralgii/artritidu, myalgii, horečku, vaskulitidu, eozinofilii a leukocytózu. Vyrážka, fotosenzitivita nebo jiné dermatologické projevy se mohou objevit samostatně nebo v kombinaci s těmito příznaky.
hydrochlorothiazid
Tělo jako celek: Slabost; Zažívací: Anorexie, podráždění žaludku, křeče, žloutenka (intrahepatální cholestatická žloutenka) (viz VAROVÁNÍ , Jaterní selhání ), pankreatitida, sialoadenitida, zácpa; Hematologické: Leukopenie, agranulocytóza, trombocytopenie, aplastická anémie, hemolytická anémie; Muskuloskeletální: Svalové křeče; Nervový systém/psychiatrický: neklid; Renální: Renální selhání, renální dysfunkce, intersticiální nefritida (viz VAROVÁNÍ ); Kůže: Erythema multiforme včetně Stevens-Johnsonova syndromu, exfoliativní dermatitida včetně toxické epidermální nekrolýzy, alopecie; Speciální smysly: xanthopsie; Přecitlivělost: Purpura, fotosenzitivita, kopřivka, nekrotizující angiitida (vaskulitida a kožní vaskulitida), respirační tíseň včetně pneumonitidy a plicního edému, anafylaktické reakce.
DROGOVÉ INTERAKCE
Lisinopril
Hypotenze -Pacienti na diuretické terapii
pacientů užívajících diuretika a zvláště u těch, u kterých byla diuretická léčba nedávno zahájena, může příležitostně dojít k nadměrnému snížení krevního tlaku po zahájení léčby lisinoprilem. Možnost hypotenzních účinků lisinoprilu lze minimalizovat buď vysazením diuretika nebo zvýšením příjmu soli před zahájením léčby lisinoprilem. Pokud je nutné v diuretiku pokračovat, zahajte léčbu lisinoprilem v dávce 5 mg denně a po úvodní dávce zajistěte pečlivý lékařský dohled po dobu nejméně dvou hodin a dokud se krevní tlak nestabilizuje po dobu nejméně další hodiny (viz VAROVÁNÍ , a DÁVKOVÁNÍ A PODÁVÁNÍ ). Když je k léčbě pacienta užívajícího lisinopril přidáno diuretikum, obvykle je pozorován další antihypertenzní účinek (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2)
pacientů, kteří jsou starší, s deplecí objemu (včetně těch, kteří jsou léčeni diuretiky) nebo s oslabenou funkcí ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s ACE inhibitory, včetně lisinoprilu, vést ke zhoršení funkce ledvin včetně možného akutního selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů léčených lisinoprilem a NSAID pravidelně monitorujte renální funkce.
Antihypertenzní účinek ACE inhibitorů, včetně lisinoprilu, může být zeslaben nesteroidními protizánětlivými léky.
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, hyperkalemie a změn renálních funkcí (včetně akutního renálního selhání) ve srovnání s monoterapií.
Do studie VA NEPHRON bylo zařazeno 1448 pacientů s diabetem 2. typu, zvýšeným poměrem albuminto-kreatinin v moči a sníženou odhadovanou glomerulární filtrací (GFR 30 až 89,9 ml/min), randomizováni k lisinoprilu nebo placebu na pozadí léčby losartanem a následně je po dobu mediánu 2,2 roku. Pacienti, kteří dostávali kombinaci losartanu a lisinoprilu, nezískali žádný další přínos ve srovnání s monoterapií pro kombinovaný cílový ukazatel poklesu GFR, konečného onemocnění ledvin nebo úmrtí, ale zaznamenali zvýšený výskyt hyperkalémie a akutního poškození ledvin ve srovnání se skupinou s monoterapií .
Obecně se vyhněte kombinovanému užívání inhibitorů RAS, pečlivě sledujte krevní tlak, renální funkce a elektrolyty u pacientů užívajících ZESTORETIC a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s přípravkem ZESTORETIC pacientům s diabetem. Vyhněte se užívání aliskirenu s přípravkem ZESTORETIC 5 mg u pacientů s poruchou funkce ledvin (GFR
Ostatní agenti
Lisinopril byl používán současně s nitráty a/nebo digoxinem bez důkazů klinicky významných nežádoucích interakcí. Při současném užívání lisinoprilu s propranololem, digoxinem nebo hydrochlorothiazidem nedošlo k žádným významným klinicky významným farmakokinetickým interakcím. Přítomnost potravy v žaludku nemění biologickou dostupnost lisinoprilu.
Činidla zvyšující sérový draslík
Lisinopril zmírňuje ztráty draslíku způsobené diuretiky thiazidového typu. Užívání lisinoprilu s draslík šetřícími diuretiky (např. spironolakton, eplerenon, triamteren nebo amilorid), doplňky draslíku nebo náhražky soli obsahující draslík může vést k významnému zvýšení sérového draslíku. Pokud je tedy indikováno současné užívání těchto látek z důvodu prokázané hypokalémie, měly by být používány s opatrností a za častého monitorování sérového draslíku.
Lithium
Toxicita lithia byla hlášena u pacientů užívajících lithium současně s léky, které způsobují eliminaci sodíku, včetně ACE inhibitorů. Toxicita lithia byla obvykle reverzibilní po vysazení lithia a ACE inhibitoru. Pokud je lisinopril podáván současně s lithiem, doporučuje se často monitorovat hladiny lithia v séru.
Inhibitory mTOR (savčí cíl rapamycinu).
U pacientů užívajících současně ACE inhibitor a mTOR inhibitor (např. temsirolimus, sirolimus, everolimus) může být zvýšené riziko angioedému. (vidět VAROVÁNÍ )
Neprilysinové inhibitory
Pacienti užívající současně inhibitory neprilysinu mohou mít zvýšené riziko angioedému. (vidět VAROVÁNÍ )
hydrochlorothiazid
Při současném podávání mohou následující léky interagovat s thiazidovými diuretiky.
Alkohol, barbituráty nebo narkotika - může dojít k potenciaci ortostatické hypotenze.
Antidiabetika (perorální léky a inzulín) - může být nutná úprava dávkování antidiabetika.
Jiná antihypertenziva -aditivní efekt nebo potenciace.
Cholestyraminové a kolestipolové pryskyřice -Absorpce hydrochlorothiazidu je narušena v přítomnosti anexových pryskyřic. Jednotlivé dávky cholestyraminu nebo kolestipolových pryskyřic vážou hydrochlorothiazid a snižují jeho absorpci z gastrointestinálního traktu až o 85 %, respektive o 43 %.
Kortikosteroidy, ACTH - zesílená deplece elektrolytů, zejména hypokalémie.
Presorické aminy (např. norepinefrin) -možná snížená odezva na presorické aminy, ale ne dostatečná k vyloučení jejich použití.
Relaxanty kosterního svalstva, nedepolarizující (např. tubokurarin) -možná zvýšená odezva na svalový relaxant.
Lithium - obecně by neměl být podáván s diuretiky. Diuretika snižují renální clearance lithia a zvyšují riziko toxicity lithia. Před použitím těchto přípravků se ZESTORETIC si přečtěte příbalovou informaci pro přípravky obsahující lithium.
Nesteroidní protizánětlivé léky -U některých pacientů může podávání nesteroidních protizánětlivých látek snížit diuretický, natriuretický a antihypertenzní účinek kličkových, draslík šetřících a thiazidových diuretik. Při současném užívání přípravku ZESTORETIC a nesteroidních protizánětlivých látek by proto měl být pacient pečlivě sledován, aby se zjistilo, zda se dosáhne požadovaného účinku přípravku ZESTORETIC 5 mg.
Zlato
Nitritoidní reakce (příznaky zahrnují zčervenání obličeje, nauzeu, zvracení a hypotenzi) byly vzácně hlášeny u pacientů léčených injekčním zlatem (aurothiomalát sodný) a souběžnou léčbou inhibitory ACE včetně přípravku ZESTORETIC.
VAROVÁNÍ
Lisinopril
Anafylaktoidní a možná související reakce
Pravděpodobně proto, že inhibitory angiotenzin konvertujícího enzymu ovlivňují metabolismus eikosanoidů a polypeptidů, včetně endogenního bradykininu, mohou být pacienti užívající ACE inhibitory (včetně ZESTORETICU) vystaveni řadě nežádoucích účinků, z nichž některé jsou závažné.
Angioedém hlavy a krku
pacientů léčených inhibitory angiotenzin konvertujícího enzymu, včetně lisinoprilu, byl hlášen angioedém obličeje, končetin, rtů, jazyka, glottis a/nebo hrtanu. K tomu může dojít kdykoli během léčby. ACE inhibitory byly spojeny s vyšším výskytem angioedému u černochů než u pacientů jiné rasy. ZESTORETIC 12,5 mg by měl být okamžitě vysazen a měla by být zajištěna vhodná léčba a monitorování, dokud nedojde k úplnému a trvalému vymizení známek a příznaků. I v těch případech, kdy se jedná pouze o otok jazyka, bez respiračních potíží, mohou pacienti vyžadovat dlouhodobé sledování, protože léčba antihistaminiky a kortikosteroidy nemusí být dostatečná. Velmi vzácně byly hlášeny případy úmrtí v důsledku angioedému spojeného s laryngeálním edémem nebo edémem jazyka. U pacientů s postižením jazyka, hlasivkové štěrbiny nebo hrtanu je pravděpodobné, že dojde k obstrukci dýchacích cest, zejména u pacientů s anamnézou operace dýchacích cest. případě postižení jazyka, hlasivkové štěrbiny nebo hrtanu, které pravděpodobně způsobí obstrukci dýchacích cest, by měl být okamžitě poskytnut podkožní roztok adrenalinu 1:1000 (0,3 ml až 0,5 ml) a/nebo opatření nezbytná k zajištění průchodnosti dýchacích cest (viz NEŽÁDOUCÍ ÚČINKY) .
Pacienti, kteří jsou současně léčeni inhibitorem ACE a inhibitorem mTOR (savčí cíl rapamycinu) (např. temsirolimus, sirolimus, everolimus) nebo inhibitorem neprilysinu, mohou mít zvýšené riziko angioedému (viz OPATŘENÍ ).
Střevní angioedém
pacientů léčených ACE inhibitory byl hlášen střevní angioedém. U těchto pacientů se objevily bolesti břicha (s nevolností nebo zvracením nebo bez nich); v některých případech nebyl v anamnéze obličejový angioedém a hladiny C-1 esterázy byly normální. Angioedém byl diagnostikován procedurami včetně CT břicha nebo ultrazvuku nebo při operaci a symptomy vymizely po vysazení ACE inhibitoru. Střevní angioedém by měl být zahrnut do diferenciální diagnózy pacientů užívajících ACE inhibitory s bolestí břicha.
Pacienti s anamnézou angioedému nesouvisejícího s léčbou ACE inhibitory mohou mít zvýšené riziko angioedému při užívání ACE inhibitoru (viz INDIKACE a KONTRAINDIKACE ).
Anafylaktoidní reakce během desenzibilizace
U dvou pacientů, kteří podstupovali desenzibilizační léčbu jedem blanokřídlých, zatímco dostávali ACE inhibitory, se udržel život ohrožující anafylaktoidní reakce.
U stejných pacientů bylo těmto reakcím zabráněno, když byly ACE inhibitory dočasně vysazeny, ale znovu se objevily po neúmyslném opětovném podání.
Anafylaktoidní reakce během expozice membrány
Kombinované přípravky obsahující thiazidy se nedoporučují u pacientů s těžkou renální dysfunkcí. Náhlé a potenciálně život ohrožující anafylaktoidní reakce byly hlášeny u některých pacientů dialyzovaných pomocí vysokoprůtokových membrán (např. AN69®**) a léčených současně ACE inhibitorem. U takových pacientů musí být dialýza okamžitě ukončena a musí být zahájena agresivní terapie anafylaktoidních reakcí. V těchto situacích nebyly příznaky zmírněny antihistaminiky. U těchto pacientů je třeba zvážit použití jiného typu dialyzační membrány nebo jiné třídy antihypertenziv. Anafylaktoidní reakce byly také hlášeny u pacientů podstupujících aferézu lipoproteinů s nízkou hustotou s absorpcí dextransulfátu.
Hypotenze a související účinky
Nadměrná hypotenze byla vzácně pozorována u nekomplikovaných hypertoniků, ale je možným důsledkem užívání lisinoprilu u osob s deplecí solí/objemu, jako jsou osoby léčené energicky diuretiky nebo pacienti na dialýze (viz DROGOVÉ INTERAKCE a NEŽÁDOUCÍ REAKCE ).

Synkopa byla hlášena u 0,8 procenta pacientů užívajících ZESTORETIC. U pacientů s hypertenzí, kteří dostávali samotný lisinopril, byla incidence synkopy 0,1 procenta. Celkový výskyt synkopy lze snížit správnou titrací jednotlivých složek (viz DROGOVÉ INTERAKCE , NEŽÁDOUCÍ REAKCE a DÁVKOVÁNÍ A PODÁVÁNÍ ).
pacientů s těžkým městnavým srdečním selháním s přidruženou renální insuficiencí nebo bez ní byla pozorována nadměrná hypotenze a může být spojena s oligurií a/nebo progresivní azotemií a vzácně s akutním renálním selháním a/nebo smrtí. Vzhledem k možnému poklesu krevního tlaku u těchto pacientů by léčba měla být zahájena pod velmi pečlivým lékařským dohledem. Tito pacienti by měli být pečlivě sledováni po dobu prvních dvou týdnů léčby a vždy, když se dávka lisinoprilu a/nebo diuretika zvýší. Podobné úvahy platí pro pacienty s ischemickou chorobou srdeční nebo cerebrovaskulárním onemocněním, u kterých by nadměrný pokles krevního tlaku mohl vést k infarktu myokardu nebo cévní mozkové příhodě.
Pokud dojde k hypotenzi, pacient by měl být uložen do polohy na zádech a v případě potřeby by měl dostat intravenózní infuzi fyziologického roztoku. Přechodná hypotenzní odpověď není kontraindikací pro další dávky, které lze obvykle bez potíží podat, jakmile se krevní tlak po zvýšení objemu zvýší.
Leukopenie/Neutropenie/Agranulocytóza
Bylo prokázáno, že další inhibitor angiotenzin-konvertujícího enzymu, kaptopril, způsobuje agranulocytózu a útlum kostní dřeně, vzácně u nekomplikovaných pacientů, ale častěji u pacientů s poruchou funkce ledvin, zvláště pokud mají také kolagenní vaskulární onemocnění. Dostupné údaje z klinických studií lisinoprilu nejsou dostatečné k tomu, aby prokázaly, že lisinopril nezpůsobuje agranulocytózu v podobné míře. Marketingové zkušenosti odhalily vzácné případy leukopenie/neutropenie a útlumu kostní dřeně, u kterých nelze vyloučit kauzální vztah k lisinoprilu. Je třeba zvážit pravidelné sledování počtu bílých krvinek u pacientů s kolagenovým vaskulárním onemocněním a onemocněním ledvin.
Jaterní selhání
Vzácně byly ACE inhibitory spojovány se syndromem, který začíná cholestatickou žloutenkou nebo hepatitidou a progreduje do fulminantní jaterní nekrózy a (někdy) smrti. Mechanismus tohoto syndromu není znám. Pacienti užívající ACE inhibitory, u kterých se rozvine žloutenka nebo výrazné zvýšení jaterních enzymů, by měli vysadit ACE inhibitor a podstoupit vhodné lékařské sledování.
Fetální toxicita
Kategorie těhotenství D
Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Při zjištění těhotenství přerušte co nejdříve ZESTORETIC. Tyto nežádoucí účinky jsou obvykle spojeny s užíváním těchto léků ve druhém a třetím trimestru těhotenství. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenzivum v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv. Vhodná léčba hypertenze matky během těhotenství je důležitá pro optimalizaci výsledků pro matku i plod.
neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativa k léčbě léky ovlivňujícími reninangiotensinový systém, informujte matku o potenciálním riziku pro plod. Proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. Pokud je pozorován oligohydramnion, přerušte léčbu přípravkem ZESTORETIC, pokud to není považováno za záchranu života matky. V závislosti na týdnu těhotenství může být vhodné provést fetální testování. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění. Pečlivě sledujte kojence s anamnézou expozice přípravku ZESTORETIC in utero kvůli hypotenzi, oligurii a hyperkalémii. (Vidět BEZPEČNOSTNÍ OPATŘENÍ, Pediatrické použití ).
Ve studiích na březích potkaních potkanech, myších a králících nebyly pozorovány žádné teratogenní účinky lisinoprilu. Na základě mg/kg byly použité dávky až 625násobek (u myší), 188násobek (u potkanů) a 0,6násobek (u králíků) maximální doporučené dávky pro člověka.
Lisinopril a hydrochlorothiazid
Studie teratogenity byly provedeny u myší a potkanů s až 90 mg/kg/den lisinoprilu (56násobek maximální doporučené dávky pro člověka) v kombinaci s 10 mg/kg/den hydrochlorothiazidu (2,5násobek maximální doporučené dávky pro člověka). U myší s touto kombinací nebyly pozorovány mateřské nebo fetotoxické účinky. U potkanů došlo ke snížení přírůstku hmotnosti matky a snížení hmotnosti plodu až na 3/10 mg/kg/den (nejnižší testovaná dávka). Se sníženou hmotností plodu bylo spojeno opoždění osifikace plodu. Snížená hmotnost plodu a zpoždění osifikace plodu nebyly pozorovány u zvířat s fyziologickým roztokem, kterým byla podávána dávka 90/10 mg/kg/den.
Při použití v těhotenství, během druhého a třetího trimestru, mohou ACE inhibitory způsobit poranění a dokonce smrt vyvíjejícího se plodu. Při zjištění těhotenství přerušte co nejdříve ZESTORETIC 5 mg ( Viz Lisinopril, Fetal Toxicity ).
hydrochlorothiazid
Akutní myopie a sekundární glaukom s uzavřeným úhlem
Hydrochlorothiazid, sulfonamid, může způsobit idiosynkratickou reakci vedoucí k akutní přechodné myopii a akutnímu glaukomu s uzavřeným úhlem. Symptomy zahrnují akutní nástup snížené zrakové ostrosti nebo bolesti oka a obvykle se objevují během hodin až týdnů po zahájení léčby. Neléčený akutní glaukom s uzavřeným úhlem může vést k trvalé ztrátě zraku. Primární léčbou je co nejrychlejší vysazení hydrochlorothiazidu. Pokud nitrooční tlak zůstává nekontrolovaný, může být nutné zvážit okamžitou lékařskou nebo chirurgickou léčbu. Rizikové faktory pro rozvoj akutního glaukomu s uzavřeným úhlem mohou zahrnovat anamnézu alergie na sulfonamidy nebo penicilin.
Teratogenní účinky
Reprodukční studie na králících, myších a potkanech v dávkách až 100 mg/kg/den (50násobek dávky pro člověka) neprokázaly žádné vnější abnormality plodu způsobené hydrochlorothiazidem. Hydrochlorothiazid podávaný ve dvouvrhové studii u potkanů v dávkách 4 mg/kg/den až 5,6 mg/kg/den (přibližně 1 až 2násobek obvyklé denní dávky pro člověka) nezhoršil plodnost ani nevyvolal porodní abnormality u potomků. Thiazidy procházejí placentární bariérou a objevují se v pupečníkové krvi.
Neteratogenní účinky
Ty mohou zahrnovat fetální nebo neonatální žloutenku, trombocytopenii a možná se u dospělých vyskytly další nežádoucí účinky.
hydrochlorothiazid
Thiazidy by měly být používány s opatrností u závažného onemocnění ledvin. U pacientů s onemocněním ledvin mohou thiazidy vyvolat azotemii. U pacientů s poruchou funkce ledvin se mohou vyvinout kumulativní účinky léku.
Thiazidy by měly být používány s opatrností u pacientů s poruchou funkce jater nebo progresivním onemocněním jater, protože drobné změny rovnováhy tekutin a elektrolytů mohou vyvolat jaterní kóma.
Reakce z přecitlivělosti se mohou objevit u pacientů s nebo bez anamnézy alergie nebo bronchiálního astmatu.
Byla hlášena možnost exacerbace nebo aktivace systémového lupus erythematodes.
Lithium by se obecně nemělo podávat s thiazidy (viz DROGOVÉ INTERAKCE , Lisinopril a hydrochlorothiazid ).
OPATŘENÍ
Všeobecné
Lisinopril
Aortální stenóza/hypertrofická kardiomyopatie
Stejně jako všechny vazodilatátory by měl být lisinopril podáván s opatrností pacientům s obstrukcí ve výtokovém traktu levé komory.
Porucha funkce ledvin
důsledku inhibice systému renin-angiotenzin-aldosteron lze u citlivých jedinců předpokládat změny funkce ledvin. U pacientů s těžkým městnavým srdečním selháním, jejichž funkce ledvin může záviset na aktivitě systému renin-angiotenzin-aldosteron, může být léčba inhibitory angiotenzin konvertujícího enzymu, včetně lisinoprilu, spojena s oligurií a/nebo progresivní azotemií a vzácně s akutním renálním selhání a/nebo smrt.
U hypertoniků s jednostrannou nebo bilaterální stenózou renální arterie může dojít ke zvýšení dusíku močoviny v krvi a sérového kreatininu. Zkušenosti s jiným inhibitorem angiotenzin-konvertujícího enzymu naznačují, že tato zvýšení jsou obvykle reverzibilní po přerušení léčby lisinoprilem a/nebo diuretiky. U těchto pacientů by měla být během prvních několika týdnů léčby sledována funkce ledvin.
některých pacientů s hypertenzí bez zjevného preexistujícího renálního vaskulárního onemocnění došlo ke zvýšení urey v krvi a sérového kreatininu, obvykle mírnému a přechodnému, zvláště když byl lisinopril podáván současně s diuretikem. To se pravděpodobněji vyskytuje u pacientů s již existující poruchou funkce ledvin. Může být nutné snížit dávku lisinoprilu a/nebo vysadit diuretikum.
Vyšetření hypertenzního pacienta by mělo vždy zahrnovat posouzení funkce ledvin (viz DÁVKOVÁNÍ A PODÁVÁNÍ).
Hyperkalémie
klinických studiích se hyperkalémie (sérový draslík vyšší než 5,7 mEq/l) objevila u přibližně 1,4 procenta pacientů s hypertenzí léčených lisinoprilem a hydrochlorothiazidem. Ve většině případů se jednalo o izolované hodnoty, které se upravily i přes pokračující terapii. Hyperkalémie nebyla příčinou přerušení léčby. Rizikové faktory pro rozvoj hyperkalemie zahrnují renální insuficienci, diabetes mellitus a současné užívání draslík šetřících diuretik, doplňků draslíku a/nebo náhražek solí obsahujících draslík. Hyperkalémie může způsobit vážné, někdy smrtelné arytmie. ZESTORETIC by se měl s těmito látkami používat opatrně, pokud vůbec, a za častého sledování hladiny draslíku v séru (viz DROGOVÉ INTERAKCE ).
Kašel
Pravděpodobně v důsledku inhibice degradace endogenního bradykininu byl u všech ACE inhibitorů hlášen přetrvávající neproduktivní kašel, který po přerušení léčby téměř vždy odezněl. Kašel vyvolaný ACE inhibitory by měl být zvažován v diferenciální diagnostice kašle.
Chirurgie/Anestezie
U pacientů podstupujících velký chirurgický výkon nebo během anestezie látkami, které vyvolávají hypotenzi, může lisinopril blokovat tvorbu angiotenzinu II sekundárně po kompenzačním uvolňování reninu. Pokud se objeví hypotenze a je považována za důsledek tohoto mechanismu, lze ji upravit objemovou expanzí.
hydrochlorothiazid
Ve vhodných intervalech by mělo být prováděno pravidelné stanovení sérových elektrolytů k detekci možné nerovnováhy elektrolytů.
všech pacientů léčených thiazidy je třeba sledovat klinické příznaky nerovnováhy tekutin nebo elektrolytů: jmenovitě hyponatrémii, hypochloremickou alkalózu a hypokalemii. Stanovení elektrolytů v séru a moči je zvláště důležité, když pacient nadměrně zvrací nebo dostává parenterální tekutiny. Varovné příznaky nebo příznaky nerovnováhy tekutin a elektrolytů, bez ohledu na příčinu, zahrnují sucho v ústech, žízeň, slabost, letargii, ospalost, neklid, zmatenost, záchvaty, svalové bolesti nebo křeče, svalovou únavu, hypotenzi, oligurii, tachykardii a gastrointestinální poruchy. jako je nevolnost a zvracení.
Může se vyvinout hypokalémie, zvláště při rychlé diuréze, při těžké cirhóze nebo po dlouhodobé léčbě.
Interference s dostatečným perorálním příjmem elektrolytů také přispěje k hypokalémii. Hypokalémie může způsobit srdeční arytmii a může také senzibilizovat nebo zveličovat reakci srdce na toxické účinky digitalisu (např. zvýšená dráždivost komor). Vzhledem k tomu, že lisinopril snižuje produkci aldosteronu, současná léčba lisinoprilem zmírňuje ztráty draslíku vyvolané diuretiky (viz DROGOVÉ INTERAKCE , Činidla zvyšující draslík v séru ).
Ačkoli jakýkoli deficit chloridů je obecně mírný a obvykle nevyžaduje specifickou léčbu, s výjimkou mimořádných okolností (jako je onemocnění jater nebo ledvin), může být při léčbě metabolické alkalózy vyžadována náhrada chloridů.
V horkém počasí se u edematózních pacientů může objevit diluční hyponatremie; vhodnou terapií je spíše omezení vody než podávání soli s výjimkou vzácných případů, kdy je hyponatremie život ohrožující. Při skutečné depleci solí je terapií volby vhodná náhrada.
některých pacientů léčených thiazidy se může vyskytnout hyperurikémie nebo se může vyvolat dna.
U diabetických pacientů může být nutná úprava dávkování inzulínu nebo perorálních hypoglykemických látek. U thiazidových diuretik se může objevit hyperglykémie. Během léčby thiazidy se tedy může projevit latentní diabetes mellitus.
Antihypertenzní účinky léku mohou být zesíleny u pacientů po sympatektomii.
Pokud se projeví progresivní porucha funkce ledvin, zvažte přerušení nebo přerušení léčby diuretiky.
Bylo prokázáno, že thiazidy zvyšují vylučování hořčíku močí; to může vést k hypomagnezémii.
Thiazidy mohou snižovat vylučování vápníku močí. Thiazidy mohou způsobit intermitentní a mírné zvýšení sérového vápníku při absenci známých poruch metabolismu vápníku. Výrazná hyperkalcémie může být důkazem skryté hyperparatyreózy. Před provedením testů funkce příštítných tělísek by měla být léčba thiazidy přerušena.
léčbou thiazidovými diuretiky může být spojeno zvýšení hladin cholesterolu a triglyceridů.
Karcinogeneze, mutageneze, zhoršení plodnosti
Lisinopril a hydrochlorothiazid
Lisinopril v kombinaci s hydrochlorothiazidem nebyl mutagenní v mikrobiálním mutagenním testu s použitím Salmonella typhimurium (Amesův test) nebo Escherichia coli s metabolickou aktivací nebo bez metabolické aktivace nebo v testu přímé mutace s použitím plicních buněk čínského křečka. Lisinopril a hydrochlorothiazid nevytvářely jednořetězcové zlomy DNA v in vitro alkalickém elučním testu potkaních hepatocytů. Navíc nezpůsobil zvýšení chromozomálních aberací v in vitro testu na ovariálních buňkách čínského křečka nebo ve studii in vivo na kostní dřeni myší.
Lisinopril
Při podávání lisinoprilu po dobu 105 týdnů samcům a samičkám potkanů v dávkách až 90 mg/kg/den (asi 56 nebo 9násobek* maximální denní dávky u člověka, na základě tělesné hmotnosti a povrchu těla) nebyly žádné důkazy o tumorogenním účinku oblast). Při podávání lisinoprilu po dobu 92 týdnů myším (samcům a samicím) v dávkách až 135 mg/kg/den (asi 84násobek* maximální doporučené denní dávky pro člověka) nebyly prokázány žádné důkazy o karcinogenitě. Tato dávka byla u myší 6,8krát vyšší než maximální dávka pro člověka založená na tělesném povrchu.
*Výpočty předpokládají lidskou hmotnost 50 kg a plochu lidského těla 1,62 m2.
Lisinopril nebyl mutagenní v Amesově mikrobiálním mutagenním testu s metabolickou aktivací nebo bez ní. Byl také negativní v testu přímé mutace s použitím plicních buněk čínského křečka. Lisinopril nevytvářel zlomy jednořetězcové DNA v in vitro alkalickém elučním testu potkaních hepatocytů. Kromě toho lisinopril nezpůsobil zvýšení chromozomálních aberací v in vitro testu na ovariálních buňkách čínského křečka nebo ve studii in vivo na kostní dřeni myší.
U samců a samic potkanů léčených až 300 mg/kg/den lisinoprilu nebyly pozorovány žádné nežádoucí účinky na reprodukční schopnost. Tato dávka je 188násobkem a 30násobkem maximální denní dávky pro člověka na základě mg/kg a mg/m2.
hydrochlorothiazid
Dvouleté studie krmení na myších a potkanech provedené pod záštitou Národního toxikologického programu (NTP) neodhalily žádné důkazy o karcinogenním potenciálu hydrochlorothiazidu u myších samic (v dávkách až přibližně 600 mg/kg/den) nebo u samců a samice potkanů (v dávkách až přibližně 100 mg/kg/den). Tyto dávky jsou 150krát a 12krát u myší a 25krát a 4krát u potkanů maximální denní dávka pro člověka na základě mg/kg a mg/m2, v daném pořadí. NTP však našel nejednoznačný důkaz hepatokarcinogenity u samců myší.
Hydrochlorothiazid nebyl genotoxický in vitro v Amesově testu mutagenity Salmonella typhimurium kmenů TA 98, TA 100, TA 1535, TA 1537 a TA 1538 a v testu ovarií čínského křečka (CHO) na chromozomální aberace při použití in vivo. chromozomy myších zárodečných buněk, chromozomy kostní dřeně čínského křečka a pohlavně vázaný recesivní letální gen Drosophila. Pozitivní výsledky testu byly získány pouze v in vitro CHO Sister Chromatid Exchange (klastogenicita) a v testech na myších lymfomových buňkách (mutagenita) s použitím koncentrací hydrochlorothiazidu od 43 mcg/ml do 1300 mcg/ml a v testu Aspergillus nidulans nondisjunction v blíže nespecifikované koncentraci.
Hydrochlorothiazid neměl žádné nepříznivé účinky na plodnost myší a potkanů jakéhokoli pohlaví ve studiích, kde byly tyto druhy vystaveny prostřednictvím stravy dávkám až 100 mg/kg a 4 mg/kg, v tomto pořadí, před početím a během březosti. . U myší je tato dávka 25násobkem a 2násobkem maximální denní dávky pro člověka na základě mg/kg a mg/m2, v daném pořadí. U potkanů je tato dávka 1násobkem a 0,2násobkem maximální denní dávky pro člověka na základě mg/kg a mg/m2.
Kojící matky
Není známo, zda se lisinopril vylučuje do lidského mateřského mléka. Mléko kojících potkanů však obsahuje po podání 14C lisinoprilu radioaktivitu. V jiné studii byl lisinopril přítomen v mléce potkanů v hladinách podobných plazmatickým hladinám u samic. Thiazidy se objevují v lidském mléce. Vzhledem k možnosti závažných nežádoucích reakcí u kojených dětí na ACE inhibitory a hydrochlorothiazid je třeba rozhodnout, zda přerušit kojení a/nebo přerušit léčbu přípravkem ZESTORETIC 12,5 mg, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Novorozenci s historií in utero expozice ZESTORETIC
Pokud se objeví oligurie nebo hypotenze, zaměřte pozornost na podporu krevního tlaku a renální perfuze. Výměnné transfuze nebo dialýza mohou být nutné jako prostředek ke zvrácení hypotenze a/nebo náhradě poruchy funkce ledvin. Lisinopril, který prochází placentou, byl odstraněn z novorozeneckého oběhu peritoneální dialýzou s určitým klinickým přínosem a teoreticky může být odstraněn výměnnou transfuzí, ačkoli s posledně jmenovaným postupem nejsou žádné zkušenosti.
Bezpečnost a účinnost u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Klinické studie přípravku ZESTORETIC mg nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují odlišně od mladších subjektů. Jiné hlášené klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty. Obecně by měl být výběr dávky pro staršího pacienta opatrný, obvykle začínající na spodní hranici dávkovacího rozmezí, což odráží vyšší frekvenci snížené funkce jater, ledvin nebo srdce a souběžného onemocnění nebo jiné lékové terapie.
Je známo, že tento lék je v podstatě vylučován ledvinami a riziko toxických reakcí na tento lék může být větší u pacientů s poruchou funkce ledvin. Vzhledem k tomu, že u starších pacientů je pravděpodobnější, že budou mít sníženou funkci ledvin, je třeba věnovat pozornost výběru dávky. Vyšetření hypertenzního pacienta by mělo vždy zahrnovat posouzení funkce ledvin.
PŘEDÁVKOVAT
Nejsou dostupné žádné specifické informace o léčbě předávkování přípravkem ZESTORETIC. Léčba je symptomatická a podpůrná. Léčba přípravkem ZESTORETIC 12,5 mg by měla být přerušena a pacient by měl být pečlivě sledován. Doporučená opatření zahrnují vyvolání zvracení a/nebo výplach žaludku a úpravu dehydratace, nerovnováhy elektrolytů a hypotenze zavedenými postupy.
Lisinopril
Po jednorázové perorální dávce 20 g/kg nedošlo u potkanů k žádné letalitě a u jedné z 20 myší, kterým byla podávána stejná dávka, došlo k úmrtí. Nejpravděpodobnějším projevem předávkování by byla hypotenze, jejíž obvyklou léčbou by byla intravenózní infuze normálního fyziologického roztoku.
Lisinopril lze odstranit hemodialýzou (viz VAROVÁNÍ , Anafylaktoidní reakce během expozice membrány ).
hydrochlorothiazid
Orální podání jedné perorální dávky 10 g/kg myším a potkanům nebylo smrtelné. Nejčastějšími pozorovanými příznaky a symptomy jsou ty, které jsou způsobeny deplecí elektrolytů (hypokalémie, hypochlorémie, hyponatremie) a dehydratací v důsledku nadměrné diurézy. Pokud byl také podán digitalis, hypokalémie může zvýraznit srdeční arytmie.
KONTRAINDIKACE
ZESTORETIC 12,5gmg je kontraindikován u pacientů s přecitlivělostí na tento přípravek au pacientů s anamnézou angioedému souvisejícího s předchozí léčbou inhibitorem angiotenzin-konvertujícího enzymu au pacientů s hereditárním nebo idiopatickým angioedémem. Vzhledem k hydrochlorothiazidové složce je tento přípravek kontraindikován u pacientů s anurií nebo přecitlivělostí na jiné léky odvozené od sulfonamidů.
ZESTORETIC 12,5 g je kontraindikován v kombinaci s inhibitorem neprilysinu (např. sakubitril). Nepodávejte ZESTORETIC 5 mg do 36 hodin po převedení na sakubitril/valsartan, inhibitor neprilysinu nebo z něj, VAROVÁNÍ ).
Nepodávejte aliskiren současně s přípravkem ZESTORETIC pacientům s diabetem (viz DROGOVÉ INTERAKCE ).
KLINICKÁ FARMAKOLOGIE
Lisinopril a hydrochlorothiazid
V důsledku svých diuretických účinků hydrochlorothiazid zvyšuje aktivitu plazmatického reninu, zvyšuje sekreci aldosteronu a snižuje hladinu draslíku v séru. Podávání lisinoprilu blokuje osu reninangiotensin aldosteron a má tendenci zvrátit ztráty draslíku spojené s diuretikem.
V klinických studiích byl rozsah snížení krevního tlaku pozorovaný u kombinace lisinoprilu a hydrochlorothiazidu přibližně aditivní. Kombinace ZESTORETIC 10-12,5 fungovala stejně dobře u černobílých pacientů. Kombinace ZESTORETIC 20-12,5 a ZESTORETIC 20-25 se zdály být poněkud méně účinné u černošských pacientů, ale bylo studováno relativně málo černých pacientů. U většiny pacientů přetrvával antihypertenzní účinek přípravku ZESTORETIC po dobu nejméně 24 hodin.
randomizovaném, kontrolovaném srovnání byly průměrné antihypertenzní účinky ZESTORETIC 20-12,5 a ZESTORETIC 20-25 podobné, což naznačuje, že mnoho pacientů, kteří adekvátně reagují na druhou kombinaci, může být kontrolováno přípravkem ZESTORETIC 20-12,5 (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Současné podávání lisinoprilu a hydrochlorothiazidu má malý nebo žádný vliv na biologickou dostupnost obou léčiv. Kombinovaná tableta je bioekvivalentní současnému podávání samostatných jednotek.
Lisinopril
Mechanismus působení
Lisinopril inhibuje angiotensin-konvertující enzym (ACE) u lidí a zvířat. ACE je peptidyldipeptidáza, která katalyzuje přeměnu angiotensinu I na vazokonstrikční látku, angiotensin II. Angiotensin II také stimuluje sekreci aldosteronu kůrou nadledvin. Inhibice ACE vede ke snížení plazmatického angiotensinu II, což vede ke snížení vazopresorické aktivity a ke snížení sekrece aldosteronu. Poslední pokles může vést k malému zvýšení sérového draslíku. Odstranění negativní zpětné vazby angiotenzinu II na sekreci reninu vede ke zvýšení aktivity plazmatického reninu. U hypertoniků s normální funkcí ledvin léčených samotným lisinoprilem po dobu až 24 týdnů bylo průměrné zvýšení sérového draslíku méně než 0,1 mEq/l; přibližně 15 procent pacientů však mělo zvýšení větší než 0,5 mEq/l a přibližně šest procent mělo pokles větší než 0,5 mEq/l. Ve stejné studii pacienti léčení lisinoprilem a thiazidovým diuretikem nevykazovali v podstatě žádné změny sérového draslíku (viz OPATŘENÍ ).
ACE je identický s kininázou, enzymem, který degraduje bradykinin. Zda zvýšené hladiny bradykininu, silného vazodepresorového peptidu, hrají roli v terapeutických účincích lisinoprilu, je třeba ještě objasnit.
Zatímco se předpokládá, že mechanismem, kterým lisinopril snižuje krevní tlak, je primárně suprese systému renin-angiotenzin-aldosteron, lisinopril je antihypertenzní i u pacientů s hypertenzí s nízkou hladinou reninu. Ačkoli byl lisinopril antihypertenzní u všech sledovaných ras, pacienti černé pleti s hypertenzí (obvykle hypertenzní populace s nízkým obsahem reninu) měli menší průměrnou odpověď na monoterapii lisinoprilem než pacienti jiné rasy.
Farmakokinetika a metabolismus
Po perorálním podání lisinoprilu se maximální sérové koncentrace dosahují přibližně za 7 hodin. Klesající sérové koncentrace vykazují prodlouženou terminální fázi, která nepřispívá k akumulaci léčiva. Tato terminální fáze pravděpodobně představuje saturovatelnou vazbu na ACE a není úměrná dávce. Nezdá se, že by se lisinopril vázal na jiné sérové proteiny.
Lisinopril nepodléhá metabolismu a je zcela vylučován v nezměněné podobě močí. Na základě výtěžku z moči je průměrný rozsah absorpce lisinoprilu přibližně 25 procent, s velkou interindividuální variabilitou (6 % až 60 %) ve všech testovaných dávkách (5 mg až 80 mg). Absorpce lisinoprilu není ovlivněna přítomností potravy v gastrointestinálním traktu.
Při opakovaném podávání lisinoprilu vykazuje efektivní poločas akumulace 12 hodin.
Porucha funkce ledvin snižuje eliminaci lisinoprilu, který je vylučován převážně ledvinami, ale tento pokles se stává klinicky významným pouze tehdy, když je rychlost glomerulární filtrace nižší než 30 ml/min. Nad touto rychlostí glomerulární filtrace se poločas eliminace jen málo mění. Při větším poškození se však maximální a minimální hladiny lisinoprilu zvyšují, doba do dosažení maximální koncentrace se prodlužuje a doba do dosažení rovnovážného stavu se prodlužuje. Starší pacienti mají v průměru (přibližně zdvojnásobené) vyšší krevní hladiny a plochu pod časovou křivkou plasmatické koncentrace (AUC) než mladší pacienti (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). Ve farmakokinetické studii s opakovanými dávkami u starších pacientů oproti mladým hypertonikům s použitím kombinace lisinopril/hydrochlorothiazid se AUC zvýšila přibližně o 120 % pro lisinopril a přibližně 80 % pro hydrochlorothiazid u starších pacientů. Lisinopril lze odstranit hemodialýzou.
Studie na potkanech ukazují, že lisinopril špatně prochází hematoencefalickou bariérou. Vícenásobné dávky lisinoprilu u potkanů nevedou k akumulaci v žádných tkáních; avšak mléko kojících potkanů obsahuje po podání 14C lisinoprilu radioaktivitu. Celotělovou autoradiografií byla radioaktivita nalezena v placentě po podání značeného léku březím potkanům, ale žádná nebyla nalezena u plodů.
Farmakodynamika
Podávání lisinoprilu pacientům s hypertenzí vede ke snížení krevního tlaku vleže i vestoje přibližně ve stejném rozsahu bez kompenzační tachykardie. Symptomatická posturální hypotenze obvykle není pozorována, ačkoli se může vyskytnout a měla by být očekávána u pacientů s deplecí objemu a/nebo solí (viz VAROVÁNÍ ).
U většiny studovaných pacientů byl nástup antihypertenzní aktivity pozorován za jednu hodinu po perorálním podání jednotlivé dávky lisinoprilu, přičemž maximálního snížení krevního tlaku bylo dosaženo za šest hodin.
některých pacientů může dosažení optimálního snížení krevního tlaku vyžadovat dva až čtyři týdny léčby.
Při doporučených jednorázových denních dávkách byly antihypertenzní účinky zachovány po dobu nejméně 24 hodin po podání, ačkoli účinek po 24 hodinách byl podstatně menší než účinek šest hodin po podání.
Antihypertenzní účinky lisinoprilu přetrvávaly během dlouhodobé léčby. Náhlé vysazení lisinoprilu nebylo spojeno s rychlým zvýšením krevního tlaku; ani s výrazným překročením krevního tlaku před léčbou.
hemodynamických studiích u pacientů s esenciální hypertenzí bylo snížení krevního tlaku doprovázeno snížením periferní arteriální rezistence s malou nebo žádnou změnou srdečního výdeje a srdeční frekvence. Ve studii u devíti pacientů s hypertenzí došlo po podání lisinoprilu ke zvýšení průměrného průtoku krve ledvinami, které nebylo významné. Údaje z několika malých studií jsou nekonzistentní, pokud jde o účinek lisinoprilu na rychlost glomerulární filtrace u hypertoniků s normální funkcí ledvin, ale naznačují, že změny, pokud nějaké jsou, nejsou velké.
U pacientů s renovaskulární hypertenzí bylo prokázáno, že lisinopril je dobře snášen a účinný při kontrole krevního tlaku (viz OPATŘENÍ ).
hydrochlorothiazid
Mechanismus antihypertenzního účinku thiazidů není znám. Thiazidy obvykle neovlivňují normální krevní tlak.
Hydrochlorothiazid je diuretikum a antihypertenzívum. Ovlivňuje distální renální tubulární mechanismus reabsorpce elektrolytů. Hydrochlorothiazid zvyšuje vylučování sodíku a chloridu v přibližně ekvivalentních množstvích. Natriuréza může být doprovázena určitou ztrátou draslíku a hydrogenuhličitanu.
Po perorálním podání začíná diuréza do dvou hodin, vrcholí asi za čtyři hodiny a trvá asi 6 až 12 hodin.
Hydrochlorothiazid není metabolizován, ale je rychle vylučován ledvinami. Pokud byly plazmatické hladiny sledovány po dobu alespoň 24 hodin, bylo pozorováno, že plazmatický poločas kolísá mezi 5,6 a 14,8 hodinami. Nejméně 61 procent perorální dávky se vyloučí v nezměněné podobě do 24 hodin. Hydrochlorothiazid prochází placentou, ale ne hematoencefalickou bariérou.
INFORMACE PRO PACIENTA
Angioedém
Angioedém, včetně laryngeálního edému, se může objevit kdykoli během léčby inhibitory angiotenzin konvertujícího enzymu, včetně přípravku ZESTORETIC. Pacienti by měli být poučeni a poučeni, aby okamžitě hlásili jakékoli známky nebo příznaky naznačující angioedém (otoky obličeje, končetin, očí, rtů, jazyka, potíže s polykáním nebo dýcháním) a aby neužívali další lék, dokud se neporadí s předepisujícím lékařem.
Symptomatická hypotenze
Pacienti by měli být upozorněni, aby hlásili závratě, zejména během prvních několika dnů léčby. Pokud se objeví skutečná synkopa, pacienti by měli být informováni, aby přerušili léčbu, dokud se neporadí s předepisujícím lékařem.
Všichni pacienti by měli být upozorněni, že nadměrné pocení a dehydratace mohou vést k nadměrnému poklesu krevního tlaku v důsledku snížení objemu tekutin. Jiné příčiny objemové deplece, jako je zvracení nebo průjem, mohou také vést k poklesu krevního tlaku; pacienti by měli být poučeni, aby se poradili se svým lékařem.
Hyperkalémie
Pacienty je třeba upozornit, aby nepoužívali náhražky soli obsahující draslík bez porady se svým lékařem.
Leukopenie/Neutropenie
Pacienti by měli být informováni, aby neprodleně hlásili jakýkoli příznak infekce (např. bolest v krku, horečka), který může být známkou leukopenie/neutropenie.
Těhotenství
Pacientky ve fertilním věku by měly být informovány o důsledcích expozice přípravku ZESTORETIC během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Pacientky by měly být požádány, aby co nejdříve hlásily těhotenství svým lékařům.
POZNÁMKA: Stejně jako u mnoha jiných léků je pro pacienty léčené přípravkem ZESTORETIC 12,5gmg nutné určité rady. Tyto informace mají pomoci při bezpečném a účinném užívání tohoto léku. Nejedná se o odhalení všech možných nepříznivých nebo zamýšlených účinků.
