Hyzaar 12.5mg Hydrochlorothiazide Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Hyzaar a jak se používá?
Hyzaar 12,5 mg je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze). Hyzaar lze užívat samostatně nebo s jinými léky.
Hyzaar patří do třídy léků nazývaných ARB/HCTZ Combos.
Není známo, zda je přípravek Hyzaar bezpečný a účinný u dětí.
Jaké jsou možné vedlejší účinky přípravku Hyzaar 12,5 mg?
Hyzaar může způsobit závažné nežádoucí účinky včetně:
- točení hlavy,
- nepravidelný srdeční tep,
- bolest očí,
- problémy se zrakem,
- malé nebo žádné močení,
- rychlý nárůst hmotnosti,
- otoky rukou, nohou nebo kotníků,
- bolest kloubů,
- kožní vyrážka na tvářích nebo pažích, která se zhoršuje slunečním zářením,
- zvýšená žízeň,
- zvýšené močení,
- zmatek,
- zvracení,
- zácpa,
- bolest svalů,
- křeče v nohou,
- těžká slabost,
- necitlivost nebo mravenčení,
- ztráta pohybu a
- pocit nervozity nebo nejistoty
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Hyzaar patří:
- závrať,
- bolesti zad a
- příznaky nachlazení (ucpaný nos, kýchání, bolest v krku)
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Hyzaar. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
Po zjištění těhotenství přerušte co nejdříve HYZAAR. Léky, které působí přímo na renin-angiotensinový systém, mohou způsobit zranění a smrt vyvíjejícího se plodu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
POPIS
Tablety HYZAAR 50/12,5 (draselná sůl losartanu-hydrochlorothiazid), HYZAAR 100/12,5 (draselná sůl losartanu hydrochlorothiazid) a HYZAAR 100/25 (draselná sůl losartanu-hydrochlorothiazid) kombinují blokátor receptoru angiotenzinu II působící na podtyp receptoru AT1 a hydrochlorothiazidové diuretikum.
Losartan draselný, nepeptidová molekula, je chemicky popsán jako monodraselná sůl 2-butyl-4-chlor-l-[p-(o-lH-tetrazol-5-ylfenyl)benzyl]imidazol-5-methanolu. Jeho empirický vzorec je C22H22ClKN6O a jeho strukturní vzorec je:
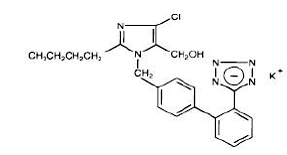
Losartan draselný je bílý až téměř bílý volně tekoucí krystalický prášek s molekulovou hmotností 461,01. Je volně rozpustný ve vodě, rozpustný v alkoholech a mírně rozpustný v běžných organických rozpouštědlech, jako je acetonitril a methylethylketon.
Oxidací 5-hydroxymethylové skupiny na imidazolovém kruhu vzniká aktivní metabolit losartan.
Hydrochlorothiazid je 6-chlor-3,4-dihydro-2H-l,2,4-benzothiadiazin-7-sulfonamid 1,1-dioxid. Jeho empirický vzorec je C7H8ClN3O4S2 a jeho strukturní vzorec je:
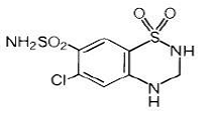
Hydrochlorothiazid je bílý nebo prakticky bílý krystalický prášek s molekulovou hmotností 297,74, který je mírně rozpustný ve vodě, ale volně rozpustný v roztoku hydroxidu sodného.
HYZAAR je k dispozici pro perorální podání ve třech kombinacích tablet losartanu a hydrochlorothiazidu. HYZAAR 50/12,5 obsahuje 50 mg losartanu draselného a 12,5 mg hydrochlorothiazidu. HYZAAR 100/12,5 obsahuje 100 mg draselné soli losartanu a 12,5 mg hydrochlorothiazidu. HYZAAR 100/25 obsahuje 100 mg draselné soli losartanu a 25 mg hydrochlorothiazidu. Neaktivními složkami jsou mikrokrystalická celulóza, hydratovaná laktóza, předbobtnalý škrob, magnesium-stearát, hydroxypropylcelulóza, hypromelóza a oxid titaničitý.
HYZAAR 50/12,5 a HYZAAR 100/25 také obsahují D&C žlutý č. 10 hliníkový lak. HYZAAR 50/12,5, HYZAAR 100/12,5 a HYZAAR 100/25 mohou také obsahovat karnaubský vosk.
HYZAAR 50/12,5 obsahuje 4,24 mg (0,108 mEq) draslíku, HYZAAR 100/12,5 obsahuje 8,48 mg (0,216 mEq) draslíku a HYZAAR 100/25 obsahuje 8,48 mg (0,216 mEq) draslíku.
INDIKACE
Hypertenze
HYZAAR® je indikován k léčbě hypertenze, ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko smrtelných a nefatálních kardiovaskulárních (KV) příhod, především mrtvice a infarktu myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd, včetně losartanu a hydrochlorothiazidu.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než 1 lék. Konkrétní rady ohledně cílů a managementu naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak (National High Blood Pressure Education Program).
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu a lze dojít k závěru, že se jedná o snížení krevního tlaku a ne o některé další farmakologické vlastnosti. léky, které jsou z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika cévní mozkové příhody, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je v populacích podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů by se dalo očekávat těžit z agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie.
Tato fixní kombinace dávek není indikována pro počáteční léčbu hypertenze, s výjimkou případů, kdy je hypertenze natolik závažná, že hodnota dosažení rychlé kontroly krevního tlaku převyšuje riziko zahájení kombinované terapie u těchto pacientů [viz Klinické studie a DÁVKOVÁNÍ A PODÁVÁNÍ ].
HYZAAR lze podávat s jinými antihypertenzivy.
Hypertenzní pacienti s hypertrofií levé komory
HYZAAR je indikován ke snížení rizika cévní mozkové příhody u pacientů s hypertenzí a hypertrofií levé komory, ale existují důkazy, že tento přínos se nevztahuje na pacienty černé pleti. [Vidět Použití u konkrétních populací , KLINICKÁ FARMAKOLOGIE , a DÁVKOVÁNÍ A PODÁVÁNÍ .]
DÁVKOVÁNÍ A PODÁVÁNÍ
Hypertenze
Obvyklá počáteční dávka přípravku HYZAAR je 50/12,5 (losartan 50 mg/hydrochlorothiazid 12,5 mg) jednou denně. Dávkování může být zvýšeno po 3 týdnech léčby maximálně na 100/25 (losartan 100 mg/hydrochlorothiazid 25 mg) jednou denně podle potřeby ke kontrole krevního tlaku (viz Klinické studie ].
U pacienta, jehož krevní tlak není adekvátně kontrolován losartem, zahajte monoterapii 50 mg přípravkem HYZAAR 50/12,5 jednou denně. Pokud krevní tlak zůstane nekontrolovaný po přibližně 3 týdnech léčby, lze dávku zvýšit na dvě tablety přípravku HYZAAR 50/12,5 jednou denně nebo jednu tabletu přípravku HYZAAR 100/25 jednou denně.
Zahajte pacienta, jehož krevní tlak není adekvátně upraven losartanem 100 mg v monoterapii přípravkem HYZAAR 100/12,5 (losartan 100 mg/hydrochlorothiazid 12,5 mg) jednou denně. Pokud krevní tlak zůstane nekontrolovaný po přibližně 3 týdnech léčby, zvyšte dávku na dvě tablety přípravku HYZAAR 50/12,5 jednou denně nebo jednu tabletu přípravku HYZAAR 100/25 jednou denně.
Pacientovi, jehož krevní tlak je nedostatečně kontrolován hydrochlorothiazidem 25 mg jednou denně nebo je kontrolován, ale trpí hypokalémií při tomto režimu, začněte užívat přípravek HYZAAR 50/12,5 jednou denně, a to snížením dávky hydrochlorothiazidu bez snížení celkové očekávané antihypertenzní odpovědi. Vyhodnoťte klinickou odpověď na přípravek HYZAAR 50/12,5 a pokud krevní tlak zůstane nekontrolovaný po přibližně 3 týdnech léčby, zvyšte dávku na dvě tablety přípravku HYZAAR 50/12,5 jednou denně nebo jednu tabletu přípravku HYZAAR 100/25 jednou denně.
Hypertenzní pacienti s hypertrofií levé komory
pacientů, jejichž krevní tlak není adekvátně kontrolován 50 mg draselné soli losartanu, zahajte léčbu přípravkem HYZAAR 50/12,5. Pokud je potřeba další snížení krevního tlaku, zvyšte dávku na HYZAAR 100/12,5 a následně na HYZAAR 100/25. Pro další snížení krevního tlaku přidejte další antihypertenziva [viz Klinické studie ].
JAK DODÁVÁNO
Dávkové formy A Síly
- HYZAAR 50/12,5 jsou žluté, oválné, potahované tablety s kódem 717 na jedné straně.
- HYZAAR 100/12,5 jsou bílé, oválné, potahované tablety s kódem 745 na jedné straně.
- HYZAAR 100/25 jsou světle žluté, oválné, potahované tablety s kódem 747 na jedné straně.
Skladování A Manipulace
HYZAAR je dodáván jako potahovaná tableta.
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F) [viz USP řízená pokojová teplota ]. Nádobu uchovávejte těsně uzavřenou. Chraňte před světlem.
Vyrobeno pro: Organon LLC, dceřiná společnost ORGANON & Co., Jersey City, NJ 07302, USA. Upraveno: červen 2021
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Losartan draselný-hydrochlorothiazid byl hodnocen z hlediska bezpečnosti u 858 pacientů léčených pro esenciální hypertenzi a 3889 pacientů léčených pro hypertenzi a hypertrofii levé komory. Většina nežádoucích účinků byla mírné a přechodné povahy a nevyžadovala přerušení léčby. V kontrolovaných klinických studiích bylo přerušení léčby z důvodu klinických nežádoucích účinků vyžadováno pouze u 2,8 % a 2,3 % pacientů léčených kombinací a placebem, v tomto pořadí.
V těchto dvojitě zaslepených kontrolovaných klinických studiích se nežádoucí účinky vyskytující se u více než 2 % subjektů léčených losartan-hydrochlorothiazidem a častěji než u placeba: bolest zad (2,1 % oproti 0,6 %), závratě (5,7 % oproti 2,9 %) a infekce horních cest dýchacích (6,1 % vs. 4,6 %).
V klinických studiích s přípravkem HYZAAR a/nebo jednotlivými složkami byly hlášeny následující další nežádoucí účinky:
Poruchy krve a lymfatického systému: Anémie, aplastická anémie, hemolytická anémie, leukopenie, agranulocytóza.
Poruchy metabolismu a výživy: Anorexie, hyperglykémie, hyperurikémie, nerovnováha elektrolytů včetně hyponatremie a hypokalémie.
Psychiatrické poruchy: Nespavost, neklid.
Poruchy nervového systému: Dysgeuzie, bolest hlavy, migréna, parestézie.
Oční poruchy: Xanthopsie, přechodné rozmazané vidění.
Srdeční poruchy: Palpitace, tachykardie.
Cévní poruchy: Ortostatické účinky závislé na dávce, nekrotizující angiitida (vaskulitida, kožní vaskulitida).
Respirační, hrudní a mediastinální poruchy: Nosní kongesce.
Gastrointestinální poruchy: Dyspepsie, bolest břicha, podráždění žaludku, křeče, nauzea, zvracení, pankreatitida, sialoadenitida.
Poruchy jater a žlučových cest: Žloutenka (intrahepatální cholestatická žloutenka).
Poruchy kůže a podkoží: Vyrážka, pruritus, purpura, toxická epidermální nekrolýza, kopřivka, fotosenzitivita, kožní lupus erythematodes.
Poruchy svalové a kosterní soustavy a pojivové tkáně: Svalové křeče, svalové křeče.
Poruchy ledvin a močových cest: Glykosurie, renální dysfunkce, intersticiální nefritida, renální selhání.
Poruchy reprodukčního systému a prsou: Erektilní dysfunkce/impotence.
Celkové poruchy a reakce v místě aplikace: Bolest na hrudi, malátnost, slabost.
Vyšetřování: Abnormality jaterních funkcí.
Kašel
Přetrvávající suchý kašel je spojován s užíváním ACE inhibitorů a v praxi může být příčinou přerušení léčby ACE inhibitory. Byly provedeny dvě prospektivní, dvojitě zaslepené, randomizované, kontrolované studie s paralelními skupinami, které měly zhodnotit účinky losartanu na výskyt kašle u pacientů s hypertenzí, kteří měli kašel při léčbě ACE inhibitory. Pacienti, kteří měli typický kašel s inhibitorem ACE při stimulaci lisinoprilem, jejichž kašel vymizel po placebu, byli randomizováni k léčbě losartanem 50 mg, lisinoprilem 20 mg nebo placebem (jedna studie, n=97) nebo 25 mg hydrochlorothiazidu (n=135). Období dvojitě zaslepené léčby trvalo až 8 týdnů. Výskyt kašle je uveden v tabulce 1 níže.
Tyto studie ukazují, že výskyt kašle souvisejícího s terapií losartanem v populaci, jejíž všichni měli kašel spojený s terapií inhibitory ACE, je podobný jako výskyt spojený s terapií hydrochlorothiazidem nebo placebem.
Po uvedení losartanu na trh byly hlášeny případy kašle, včetně pozitivních opakovaných provokací.
Postmarketingové zkušenosti
Během používání přípravku HYZAAR po schválení byly zjištěny následující nežádoucí účinky. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku.
Zažívací: Hepatitida byla u pacientů léčených losartanem hlášena vzácně.
Hematologické: Trombocytopenie.
Přecitlivělost: U pacientů léčených losartanem byl vzácně hlášen angioedém, včetně otoku hrtanu a hlasivkové štěrbiny, způsobující obstrukci dýchacích cest a/nebo otok obličeje, rtů, hltanu a/nebo jazyka; někteří z těchto pacientů dříve prodělali angioedém s jinými léky včetně ACE inhibitorů. V souvislosti s losartanem byla hlášena vaskulitida, včetně Henoch-Schönleinovy purpury. Byly hlášeny anafylaktické reakce.
Muskuloskeletální: Rabdomyolýza.
Kůže: Erytrodermie.
Nemelanomová rakovina kůže: Hydrochlorothiazid je spojován se zvýšeným rizikem nemelanomové rakoviny kůže. Ve studii provedené v systému Sentinel bylo zvýšené riziko především u spinocelulárního karcinomu (SCC) au bílých pacientů užívajících velké kumulativní dávky. Zvýšené riziko SCC v celkové populaci bylo přibližně 1 další případ na 16 000 pacientů za rok a u bílých pacientů užívajících kumulativní dávku ≥ 50 000 mg bylo zvýšení rizika přibližně o 1 další případ SCC na každých 6 700 pacientů za rok.
DROGOVÉ INTERAKCE
Činidla zvyšující sérový draslík
Současné podávání losartanu s jinými léky, které zvyšují hladiny draslíku v séru, může vést k hyperkalémii. U těchto pacientů monitorujte hladinu draslíku v séru.
Lithium
Při současném užívání antagonistů receptoru angiotenzinu II nebo thiazidových diuretik bylo hlášeno zvýšení sérových koncentrací lithia a toxicita lithia. Monitorujte hladiny lithia u pacientů užívajících přípravek HYZAAR 12,5 mg a lithium.
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů cyklooxygenázy-2
Losartan draselný
pacientů, kteří jsou starší, s deplecí objemu (včetně pacientů na diuretické léčbě) nebo s oslabenou funkcí ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s antagonisty receptoru angiotenzinu II (včetně losartanu) vést ke zhoršení funkce ledvin, včetně možného akutního selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů léčených losartanem a NSAID pravidelně monitorujte renální funkce.
Antihypertenzní účinek antagonistů receptoru angiotenzinu II, včetně losartanu, může být zeslaben NSAID, včetně selektivních inhibitorů COX-2.
hydrochlorothiazid
Podávání nesteroidních protizánětlivých látek včetně selektivního inhibitoru COX-2 může snížit diuretický, natriuretický a antihypertenzní účinek smyčkových, draslík šetřících a thiazidových diuretik. Proto při současném užívání přípravku HYZAAR a nesteroidních protizánětlivých látek včetně selektivních inhibitorů COX-2 pečlivě sledujte, zda se dosáhne požadovaného účinku diuretika.
pacientů léčených diuretiky může současné podávání NSAID s blokátory receptorů angiotenzinu, včetně losartanu, vést ke zhoršení funkce ledvin, včetně možného akutního selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů léčených hydrochlorothiazidem, losartanem a NSAID pravidelně monitorujte renální funkce.
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, synkopy, hyperkalemie a změn renálních funkcí (včetně akutního renálního selhání) ve srovnání s monoterapií.
Do studie Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) bylo zařazeno 1448 pacientů s diabetem 2. typu, zvýšeným poměrem albuminu a kreatininu v moči a sníženou odhadovanou rychlostí glomerulární filtrace (GFR 30 až 89,9 ml/min). lisinopril nebo placebo na pozadí léčby losartanem a sledovali je po dobu mediánu 2,2 roku. Pacienti užívající kombinaci losartanu a lisinoprilu nezískali žádný další přínos ve srovnání s monoterapií pro kombinovaný cílový ukazatel poklesu GFR, konečného stádia renálního onemocnění nebo úmrtí, ale zaznamenali zvýšený výskyt hyperkalémie a akutního poškození ledvin ve srovnání s monoterapií skupina.
Pečlivě sledujte krevní tlak, funkci ledvin a elektrolyty u pacientů užívajících přípravek HYZAAR 12,5 mg a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s přípravkem HYZAAR 12,5 mg pacientům s diabetem. Vyhněte se použití aliskirenu s přípravkem HYZAAR 12,5 mg u pacientů s poruchou funkce ledvin (GFR
Použití hydrochlorothiazidu s jinými léky
Při současném podávání mohou následující léky interagovat s thiazidovými diuretiky (viz KLINICKÁ FARMAKOLOGIE ]:
Antidiabetika (perorální léky a inzulín) – může být nutná úprava dávkování antidiabetika.
Cholestyraminové a kolestipolové pryskyřice - Absorpce hydrochlorothiazidu je narušena v přítomnosti aniontoměničových pryskyřic. Jednotlivé dávky cholestyraminu nebo kolestipolových pryskyřic vážou hydrochlorothiazid a snižují jeho absorpci z gastrointestinálního traktu až o 85 a 43 procent.
Rozložte dávku hydrochlorothiazidu a pryskyřice tak, aby se hydrochlorothiazid podával alespoň 4 hodiny před nebo 4 až 6 hodin po podání pryskyřice.
VAROVÁNÍ
Zahrnuto jako součást "OPATŘENÍ" Sekce
OPATŘENÍ
Fetální toxicita
Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Při zjištění těhotenství přerušte co nejdříve HYZAAR 12,5 mg.
Thiazidy procházejí placentární bariérou a objevují se v pupečníkové krvi. Mezi nežádoucí účinky patří fetální nebo novorozenecká žloutenka, trombocytopenie [viz Použití u konkrétních populací ].
Hypotenze u pacientů se sníženým objemem nebo solí
U pacientů s aktivovaným systémem renin-angiotenzin, jako jsou pacienti s deplecí objemu nebo solí (např. pacienti léčení vysokými dávkami diuretik), se po zahájení léčby přípravkem HYZAAR může objevit symptomatická hypotenze. Před podáním přípravku HYZAAR upravte depleci objemu nebo soli. Nepoužívejte HYZAAR jako počáteční léčbu u pacientů s deplecí intravaskulárního objemu.
Porucha funkce ledvin
Změny renálních funkcí včetně akutního renálního selhání mohou být způsobeny léky, které inhibují reninangiotensinový systém a diuretiky. Pacienti, jejichž funkce ledvin může částečně záviset na aktivitě renin-angiotenzinového systému (např. pacienti se stenózou renální arterie, chronickým onemocněním ledvin, těžkým městnavým srdečním selháním nebo deplecí objemu), mohou být zvláště ohroženi rozvojem akutního selhání ledvin při HYZAAR. U těchto pacientů pravidelně sledujte renální funkce. Zvažte pozastavení nebo přerušení léčby u pacientů, u kterých dojde ke klinicky významnému snížení renálních funkcí na HYZAAR (viz DROGOVÉ INTERAKCE a Použití u konkrétních populací ].
Přecitlivělost
Hypersenzitivní reakce na hydrochlorothiazid se mohou objevit u pacientů s alergií nebo bronchiálním astmatem v anamnéze nebo bez nich, ale jsou pravděpodobnější u pacientů s takovou anamnézou.
Elektrolytové A Metabolické Účinky
Ve dvojitě zaslepených klinických studiích různých dávek draselné soli losartanu a hydrochlorothiazidu byla incidence hypertoniků, u kterých se rozvinula hypokalémie (sérový draslík 5,7 mEq/l) byl 0,4 % oproti 0 % u placeba.
HYZAAR obsahuje hydrochlorothiazid, který může způsobit hypokalémii, hyponatrémii a hypomagnezémii. Hypomagnezémie může vést k hypokalémii, kterou může být obtížné léčit navzdory doplňování draslíku. HYZAAR 12,5 mg také obsahuje losartan, který může způsobit hyperkalémii. Pravidelně monitorujte sérové elektrolyty [viz DROGOVÉ INTERAKCE ].
Současné užívání jiných léků, které mohou zvýšit hladinu draslíku v séru, může vést k hyperkalémii (viz DROGOVÉ INTERAKCE ].
Hydrochlorothiazid může změnit glukózovou toleranci a zvýšit sérové hladiny cholesterolu a triglyceridů.
U pacientů léčených thiazidy se může vyskytnout hyperurikémie nebo se může vyvolat dna. Protože losartan snižuje kyselinu močovou, losartan v kombinaci s hydrochlorothiazidem zmírňuje diuretiky indukovanou hyperurikémii.
Hydrochlorothiazid snižuje vylučování vápníku močí a může způsobit zvýšení sérového vápníku. Sledujte hladiny vápníku.
Akutní myopie a sekundární glaukom s uzavřeným úhlem
Hydrochlorothiazid, sulfonamid, může způsobit idiosynkratickou reakci vedoucí k akutní přechodné myopii a akutnímu glaukomu s uzavřeným úhlem. Symptomy zahrnují akutní nástup snížené zrakové ostrosti nebo bolesti oka a obvykle se objevují během hodin až týdnů po zahájení léčby. Neléčený akutní glaukom s uzavřeným úhlem může vést k trvalé ztrátě zraku. Primární léčbou je co nejrychlejší vysazení hydrochlorothiazidu. Pokud nitrooční tlak zůstává nekontrolovaný, může být nutné zvážit okamžitou lékařskou nebo chirurgickou léčbu. Rizikové faktory pro rozvoj akutního glaukomu s uzavřeným úhlem mohou zahrnovat anamnézu alergie na sulfonamidy nebo penicilin.
Systémový lupus erythematodes
Bylo hlášeno, že thiazidová diuretika způsobují exacerbaci nebo aktivaci systémového lupus erythematodes.
Pacienti po sympatektomii
Antihypertenzní účinky léku mohou být zesíleny u pacientů po sympatektomii.
Informace pro pacienty
Doporučte pacientovi, aby si přečetl označení pacienta schválené FDA ( INFORMACE PRO PACIENTA ).
Těhotenství
Informujte pacientky ve fertilním věku o důsledcích expozice přípravku HYZAAR 12,5 mg během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Řekněte pacientkám, aby co nejdříve hlásili těhotenství svým lékařům [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].

Symptomatická hypotenze
Upozorněte pacienty, že se může objevit závratě, zejména během prvních dnů léčby, a hlásit tento příznak poskytovateli zdravotní péče. Informujte pacienty, že dehydratace z nedostatečného příjmu tekutin, nadměrného pocení, zvracení nebo průjmu může vést k nadměrnému poklesu krevního tlaku. Pokud se objeví synkopa, poraďte pacientům, aby kontaktovali svého poskytovatele zdravotní péče [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Draslíkové doplňky
Poraďte pacientům, aby nepoužívali doplňky draslíku nebo náhražky soli obsahující draslík bez konzultace se svým poskytovatelem zdravotní péče [viz DROGOVÉ INTERAKCE ].
Akutní myopie a sekundární glaukom s uzavřeným úhlem
Informujte pacienty, aby přerušili léčbu přípravkem HYZAAR 12,5 mg a okamžitě vyhledali lékařskou pomoc, pokud se u nich objeví příznaky akutní myopie nebo sekundárního glaukomu s uzavřeným úhlem [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Losartan draselný-hydrochlorothiazid
Nebyly provedeny žádné studie kancerogenity s kombinací losartan draselný-hydrochlorothiazid.
Losartan draselný-hydrochlorothiazid, když byl testován v hmotnostním poměru 4:1, byl negativní v Amesově testu mikrobiální mutageneze a testu mutageneze plicních buněk čínského křečka V-79. Kromě toho nebyly žádné důkazy přímé genotoxicity v in vitro alkalickém elučním testu na potkaních hepatocytech a in vitro testu chromozomálních aberací v buňkách vaječníků čínského křečka v necytotoxických koncentracích.
Losartan draselný podávaný spolu s hydrochlorothiazidem neměl žádný vliv na fertilitu nebo páření samců potkanů v dávkách až 135 mg/kg/den losartanu a 33,75 mg/kg/den hydrochlorothiazidu. Ukázalo se, že tyto dávky poskytují příslušné systémové expozice (AUC) losartanu, jeho aktivnímu metabolitu a hydrochlorothiazidu, které jsou přibližně 60, 60 a 30krát vyšší než ty, kterých je dosaženo u lidí se 100 mg draselné soli losartanu v kombinaci s 25 mg hydrochlorothiazidu. U samic potkanů však bylo společné podávání dávek 10 mg/kg/den losartanu a 2,5 mg/kg/den hydrochlorothiazidu spojeno s mírným, ale statisticky významným snížením indexů plodnosti a fertility. Hodnoty AUC pro losartan, jeho aktivní metabolit a hydrochlorothiazid, extrapolované z údajů získaných s losartanem podávaným potkanům v dávce 50 mg/kg/den v kombinaci s 12,5 mg/kg/den hydrochlorothiazidu, byly přibližně 6, 2 a 2 krát vyšší než u lidí se 100 mg losartanu v kombinaci s 25 mg hydrochlorothiazidu.
Losartan draselný
Losartan draselný nebyl karcinogenní, když byl podáván v maximálních tolerovaných dávkách potkanům a myším po dobu 105 a 92 týdnů. Samice potkanů, kterým byla podávána nejvyšší dávka (270 mg/kg/den), měly mírně vyšší výskyt acinárního adenomu pankreatu. Maximální tolerované dávky (270 mg/kg/den u potkanů, 200 mg/kg/den u myší) poskytly systémové expozice losartanu a jeho farmakologicky aktivního metabolitu, které byly přibližně 160krát a 90krát (krysy) a 30krát a 15krát (myši). ) expozice člověka o hmotnosti 50 kg, kterému je podáváno 100 mg denně.
Losartan draselný byl negativní v testech mikrobiální mutageneze a mutageneze savčích buněk V-79 a v testech in vitro alkalické eluce a in vitro a in vivo testech chromozomálních aberací. Kromě toho aktivní metabolit nevykazoval žádné známky genotoxicity v testech mikrobiální mutageneze, in vitro alkalické eluce a in vitro testů chromozomálních aberací.
Fertilita a reprodukční schopnost nebyly ovlivněny ve studiích se samci potkanů, kterým byly perorálně podávány dávky draselného losartanu až do přibližně 150 mg/kg/den. Podání toxických dávek u žen (300/200 mg/kg/den) bylo spojeno s významným (p
hydrochlorothiazid
Dvouleté studie krmení na myších a potkanech provedené pod záštitou Národního toxikologického programu (NTP) neodhalily žádné důkazy o karcinogenním potenciálu hydrochlorothiazidu u myších samic (v dávkách až přibližně 600 mg/kg/den) nebo u samců a samice potkanů (v dávkách až přibližně 100 mg/kg/den). NTP však našel nejednoznačný důkaz hepatokarcinogenity u samců myší.
Hydrochlorothiazid nebyl genotoxický in vitro v Amesově testu mutagenity Salmonella typhimurium kmenů TA 98, TA 100, TA 1535, TA 1537 a TA 1538 a v testu ovarií čínského křečka (CHO) na chromozomální aberace při použití in vivo. chromozomy myších zárodečných buněk, chromozomy kostní dřeně čínského křečka a pohlavně vázaný recesivní letální gen Drosophila. Pozitivní výsledky testů byly získány pouze v in vitro CHO Sister Chromatid Exchange (klastogenicita) a v testech na myších lymfomových buňkách (mutagenita) s použitím koncentrací hydrochlorothiazidu od 43 do 1300 mcg/ml a v testu Aspergillus nidulans non-disjunktion at blíže nespecifikovanou koncentraci.
Hydrochlorothiazid neměl žádné nepříznivé účinky na fertilitu myší a potkanů jakéhokoli pohlaví ve studiích, kde byly tyto druhy vystaveny prostřednictvím stravy dávkám až 100 a 4 mg/kg před pářením a během březosti.
Použití u konkrétních populací
Těhotenství
Kategorie těhotenství D
Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Když je zjištěno těhotenství, vysaďte losartan co nejdříve. Tyto nežádoucí účinky jsou obvykle spojeny s užíváním těchto léků ve druhém a třetím trimestru těhotenství. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenzivum v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv. Vhodná léčba hypertenze matky během těhotenství je důležitá pro optimalizaci výsledků pro matku i plod.
neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativa k léčbě léky ovlivňujícími reninangiotensinový systém, informujte matku o potenciálním riziku pro plod. Proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. Pokud je pozorován oligohydramnion, přerušte léčbu přípravkem HYZAAR, pokud to není považováno za záchranu života matky. V závislosti na týdnu těhotenství může být vhodné provést fetální testování. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění. Pečlivě sledujte kojence s anamnézou in utero expozice přípravku HYZAAR 12,5 mg pro hypotenzi, oligurii a hyperkalemii [viz Pediatrické použití ].
potkanů nebo králíků léčených maximální dávkou draselného losartanu 10 mg/kg/den v kombinaci s hydrochlorothiazidem v dávce 2,5 mg/kg/den nebyla prokázána teratogenita. Při těchto dávkách byly příslušné expozice (AUC) losartanu, jeho aktivního metabolitu a hydrochlorothiazidu u králíků přibližně 5, 1,5 a 1,0krát vyšší, než je u lidí dosaženo se 100 mg losartanu v kombinaci s 25 mg hydrochlorothiazidu. Hodnoty AUC pro losartan, jeho aktivní metabolit a hydrochlorothiazid, extrapolované z údajů získaných s losartanem podávaným potkanům v dávce 50 mg/kg/den v kombinaci s 12,5 mg/kg/den hydrochlorothiazidu, byly přibližně 6, 2 a 2 krát vyšší než u lidí se 100 mg losartanu v kombinaci s 25 mg hydrochlorothiazidu. Fetální toxicita u potkanů, o čemž svědčí mírné zvýšení nadpočetných žeber, byla pozorována, když byly samice léčeny před a během březosti losartanem v dávce 10 mg/kg/den v kombinaci s hydrochlorothiazidem v dávce 2,5 mg/kg/den. Jak bylo také pozorováno ve studiích se samotným losartanem, nežádoucí účinky na plod a novorozence, včetně snížení tělesné hmotnosti, renální toxicity a mortality, se objevily, když byly březím potkanům během pozdní březosti a/nebo laktace podávány losartan v dávce 50 mg/kg/den v kombinaci s 12,5 mg/kg/den hydrochlorothiazidu. Příslušné AUC losartanu, jeho aktivního metabolitu a hydrochlorothiazidu v těchto dávkách u potkanů byly přibližně 35, 10 a 10krát vyšší než hodnoty dosažené u lidí při podání 100 mg losartanu v kombinaci s 25 mg hydrochlorothiazidu. Když byl hydrochlorothiazid podáván bez losartanu březím myším a potkanům během jejich příslušných období hlavní organogeneze, v dávkách až 3000 a 1000 mg/kg/den, v daném pořadí, nebyly žádné známky poškození plodu.
Thiazidy procházejí placentární bariérou a objevují se v pupečníkové krvi. Existuje riziko fetální nebo novorozenecké žloutenky, trombocytopenie a případně dalších nežádoucích účinků, které se vyskytly u dospělých.
Kojící matky
Není známo, zda je losartan vylučován do mateřského mléka, ale v mléce potkanů byly prokázány významné hladiny losartanu a jeho aktivního metabolitu. Thiazidy se objevují v lidském mléce. Vzhledem k potenciálu nežádoucích účinků na kojené dítě je třeba rozhodnout, zda přerušit kojení nebo přerušit podávání léku, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Bezpečnost a účinnost přípravku HYZAAR u pediatrických pacientů nebyla stanovena.
Novorozenci s historií in utero expozice HYZAAR
Pokud se objeví oligurie nebo hypotenze, zaměřte pozornost na podporu krevního tlaku a renální perfuze. Může být zapotřebí výměnná transfuze nebo dialýza jako prostředek ke zvrácení hypotenze a/nebo náhradě poruchy funkce ledvin.
Geriatrické použití
kontrolované klinické studii na snížení kombinovaného rizika kardiovaskulární smrti, cévní mozkové příhody a infarktu myokardu u hypertoniků s hypertrofií levé komory bylo 2 857 pacientů (62 %) ve věku 65 let a více, zatímco 808 pacientům (18 %) bylo 75 let a více. Ve snaze kontrolovat krevní tlak v této studii byl pacientům současně podáván losartan a hydrochlorothiazid po 74 % celkové doby, kdy byli na studovaném léku. Mezi těmito pacienty a mladšími pacienty nebyly pozorovány žádné celkové rozdíly v účinnosti. Nežádoucí účinky byly o něco častější u starších pacientů ve srovnání s mladšími pacienty jak u losartan-hydrochlorothiazidové, tak u kontrolní skupiny (viz KLINICKÁ FARMAKOLOGIE ].
Závod
Ve studii Losartan Intervention For Endpoint reduction in hypertension (LIFE) měli černošští pacienti s hypertenzí a hypertrofií levé komory léčení atenololem nižší riziko cévní mozkové příhody, což je primární složený cílový ukazatel, ve srovnání s černošskými pacienty léčenými losartanem (oba současně léčeni hydrochlorothiazidem u většiny pacientů). V podskupině černošských pacientů (n=533, 6 % pacientů ve studii LIFE) bylo 29 primárních cílových ukazatelů mezi 263 pacienty na atenololu (11 %, 26 na 1000 pacientoroků) a 46 primárních cílových ukazatelů mezi 270 pacienty (17 %, 42 na 1000 pacientoroků) na losartanu. Toto zjištění nemohlo být vysvětleno na základě rozdílů v populacích jiných než rasa nebo na jakékoli nevyváženosti mezi léčebnými skupinami. Navíc snížení krevního tlaku v obou léčebných skupinách bylo konzistentní u černošských a nečerných pacientů. Vzhledem k obtížnosti interpretace rozdílů podmnožin ve velkých studiích nelze vědět, zda je pozorovaný rozdíl výsledkem náhody. Studie LIFE však neposkytuje žádný důkaz, že přínos losartanu na snížení rizika kardiovaskulárních příhod u hypertoniků s hypertrofií levé komory se vztahuje na pacienty černé pleti [viz KLINICKÁ FARMAKOLOGIE ].
Poškození jater
Zahájení léčby přípravkem HYZAAR 12,5 mg se nedoporučuje u pacientů s poruchou funkce jater, protože vhodná počáteční dávka losartanu, 25 mg, není k dispozici.
Renální poškození
U vnímavých jedinců byly hlášeny změny renálních funkcí [viz DÁVKOVÁNÍ A PODÁVÁNÍ , VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ , a KLINICKÁ FARMAKOLOGIE ]. Bezpečnost a účinnost přípravku HYZAAR u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu
PŘEDÁVKOVAT
Losartan draselný
Významná letalita byla pozorována u myší a potkanů po perorálním podání 1000 mg/kg a 2000 mg/kg, v daném pořadí, což je asi 44 a 170násobek maximální doporučené dávky pro člověka na základě mg/m.
předávkování u lidí jsou k dispozici omezené údaje. Nejpravděpodobnějším projevem předávkování by byla hypotenze a tachykardie; bradykardie se může objevit z parasympatické (vagální) stimulace. Pokud dojde k symptomatické hypotenzi, je třeba zahájit podpůrnou léčbu.
Losartan ani jeho aktivní metabolit nelze odstranit hemodialýzou.
hydrochlorothiazid
Perorální LD hydrochlorothiazidu je vyšší než 10 g/kg u myší i potkanů. Nejčastějšími pozorovanými příznaky a symptomy jsou ty, které jsou způsobeny vyčerpáním elektrolytů (hypokalémie, hypochlorémie, hyponatremie) a dehydratací v důsledku nadměrné diurézy. Pokud byl také podán digitalis, hypokalémie může zvýraznit srdeční arytmie. Stupeň, do kterého je hydrochlorothiazid odstraněn hemodialýzou, nebyl stanoven.
KONTRAINDIKACE
HYZAAR 12,5 mg je kontraindikován:
- U pacientů, kteří jsou přecitlivělí na kteroukoli složku tohoto přípravku.
- U pacientů s anurií
- Pro současné podávání s aliskirenem u pacientů s diabetem
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Losartan draselný
Angiotenzin II [vzniká z angiotenzinu I reakcí katalyzovanou angiotensin konvertujícím enzymem (ACE, kinináza II)] je silný vazokonstriktor, primární vazoaktivní hormon systému renin-angiotenzin a důležitá složka v patofyziologii hypertenze. Stimuluje také sekreci aldosteronu kůrou nadledvin. Losartan a jeho hlavní aktivní metabolit blokují vazokonstrikční a aldosteron vylučující účinky angiotensinu II selektivním blokováním vazby angiotenzinu II na AT1 receptor, který se nachází v mnoha tkáních (např. hladké svalstvo cév, nadledvinka). V mnoha tkáních se také nachází receptor AT2, ale není známo, že by byl spojen s kardiovaskulární homeostázou. Ani losartan, ani jeho hlavní aktivní metabolit nevykazují žádnou částečnou agonistickou aktivitu na receptoru AT1 a oba mají mnohem větší afinitu (asi 1000krát) k receptoru AT1 než k receptoru AT2. Vazebné studie in vitro ukazují, že losartan je reverzibilní, kompetitivní inhibitor receptoru AT1. Aktivní metabolit je hmotnostně 10 až 40krát účinnější než losartan a zdá se, že jde o reverzibilní, nekompetitivní inhibitor receptoru AT1.
Losartan ani jeho aktivní metabolit neinhibují ACE (kininázu II, enzym, který přeměňuje angiotensin I na angiotenzin II a odbourává bradykinin), ani se nevážou ani neblokují jiné hormonální receptory nebo iontové kanály, o nichž je známo, že jsou důležité v kardiovaskulární regulaci.
hydrochlorothiazid
Hydrochlorothiazid je thiazidové diuretikum. Thiazidy ovlivňují renální tubulární mechanismy reabsorpce elektrolytů, přímo zvyšují vylučování sodíku a chloridu v přibližně ekvivalentních množstvích. Nepřímo diuretický účinek hydrochlorothiazidu snižuje objem plazmy s následným zvýšením plazmatické reninaktivity, zvýšením sekrece aldosteronu, zvýšením ztrát draslíku močí a snížením draslíku v séru. Spojení renin-aldosteron je zprostředkováno angiotensinem II, takže společné podávání antagonisty receptoru angiotenzinu II má tendenci zvrátit ztráty draslíku spojené s těmito diuretiky. Mechanismus antihypertenzního účinku thiazidů není znám.
Farmakodynamika
Losartan draselný
Losartan inhibuje presorický účinek infuzí angiotensinu II (stejně jako angiotenzinu I). Dávka 100 mg inhibuje presorický účinek asi o 85 % na vrcholu, přičemž 25-40 % inhibice přetrvává po dobu 24 hodin. Odstranění negativní zpětné vazby angiotenzinu II způsobuje zdvojnásobení až ztrojnásobení plazmatické aktivity reninu a následné zvýšení plazmatické koncentrace angiotenzinu II u hypertoniků. Losartan neovlivňuje odpověď na bradykinin, zatímco inhibitory ACE zvyšují odpověď na bradykinin. Plazmatické koncentrace aldosteronu po podání losartanu klesají. Navzdory účinku losartanu na sekreci aldosteronu byl pozorován velmi malý účinek na hladinu draslíku v séru.
Účinek losartanu je v podstatě přítomen během jednoho týdne, ale v některých studiích se maximální účinek objevil za 3-6 týdnů. V dlouhodobých následných studiích (s outplacebovou kontrolou) se zdálo, že účinek losartanu přetrvává až po dobu jednoho roku. Po náhlém vysazení losartanu není patrný žádný rebound fenomén. V kontrolovaných studiích nedošlo v podstatě k žádné změně průměrné srdeční frekvence u pacientů léčených losartanem.
hydrochlorothiazid
Po perorálním podání hydrochlorothiazidu začíná diuréza během 2 hodin, vrcholí přibližně za 4 hodiny a trvá přibližně 6 až 12 hodin.
Lékové interakce
hydrochlorothiazid
Alkohol, barbituráty nebo narkotika - může dojít k potenciaci ortostatické hypotenze.
Jiná antihypertenziva - aditivní efekt nebo potenciace.
Relaxanty kosterního svalstva, nedepolarizující (např. tubokurarin) - možná zvýšená odezva na svalový relaxant.
Kortikosteroidy, ACTH nebo glycyrrhizin (nachází se v lékořici) - zesílená deplece elektrolytů, zejména hypokalémie.
Presorické aminy (např. norepinefrin) - možná snížená odezva na presorické aminy, ale ne dostatečná k vyloučení jejich použití.
Farmakokinetika
Losartan draselný
Vstřebávání
Po perorálním podání se losartan dobře vstřebává a podléhá podstatnému metabolismu prvního průchodu játry. Systémová biologická dostupnost losartanu je přibližně 33 %. Průměrné maximální koncentrace losartanu a jeho aktivního metabolitu jsou dosaženy za 1 hodinu, respektive za 3-4 hodiny. Zatímco maximální plazmatické koncentrace losartanu a jeho aktivního metabolitu jsou přibližně stejné, AUC (plocha pod křivkou) metabolitu je asi 4krát větší než u losartanu. Jídlo zpomaluje absorpci losartanu a snižuje jeho Cmax max, ale má pouze malý vliv na AUC losartanu nebo na AUC metabolitu (~10% snížení). Farmakokinetika losartanu a jeho aktivního metabolitu je lineární při perorálních dávkách losartanu až do 200 mg a v průběhu času se nemění.
Rozdělení
Distribuční objem losartanu a aktivního metabolitu je asi 34 litrů, respektive 12 litrů. Losartan i jeho aktivní metabolit se vysoce váží na plazmatické proteiny, především albumin, s plazmatickými volnými frakcemi 1,3 % a 0,2 %. Vazba na plazmatické proteiny je konstantní v rozsahu koncentrací dosažených doporučenými dávkami. Studie na potkanech ukazují, že losartan prochází hematoencefalickou bariérou špatně, pokud vůbec.
Metabolismus
Losartan je perorálně účinná látka, která podléhá podstatnému metabolismu prvního průchodu enzymy cytochromu P450. Částečně se přeměňuje na aktivní metabolit karboxylové kyseliny, který je odpovědný za většinu antagonismu receptoru angiotensinu II, který následuje po léčbě losartanem. Asi 14 % perorálně podané dávky losartanu se přemění na aktivní metabolit. Kromě aktivního metabolitu karboxylové kyseliny se tvoří několik neaktivních metabolitů. Studie in vitro ukazují, že cytochrom P450 2C9 a 3A4 se účastní biotransformace losartanu na jeho metabolity.
Odstranění
Celková plazmatická clearance losartanu a aktivního metabolitu je přibližně 600 ml/min, respektive 50 ml/min, s renální clearance přibližně 75 ml/min a 25 ml/min. Terminální poločas losartanu je asi 2 hodiny a metabolitu asi 6-9 hodin. Po jednotlivých dávkách losartanu podaných perorálně se asi 4 % dávky vyloučí v nezměněné podobě močí a asi 6 % se vyloučí močí jako aktivní metabolit. Vylučování žlučí přispívá k eliminaci oflosartanu a jeho metabolitů. Po perorálním podání losartanu značeného 14C se asi 35 % radioaktivity objeví v moči a asi 60 % ve stolici. Po intravenózní dávce losartanu značeného 14C se asi 45 % radioaktivity objeví v moči a 50 % ve stolici. Losartan ani jeho metabolit se nehromadí v plazmě při opakovaném podávání jednou denně.
hydrochlorothiazid
Hydrochlorothiazid není metabolizován, ale je rychle vylučován ledvinami. Pokud byly plazmatické hladiny sledovány po dobu alespoň 24 hodin, bylo pozorováno, že plazmatický poločas kolísá mezi 5,6 a 14,8 hodinami. Nejméně 61 procent perorální dávky se vyloučí v nezměněné podobě do 24 hodin. Hydrochlorothiazid prochází placentou, ale ne hematoencefalickou bariérou, a je vylučován do mateřského mléka.
Specifické populace
Geriatrické a genderové
Farmakokinetika losartanu byla zkoumána u starších osob (65-75 let) au obou pohlaví. Plazmatické koncentrace losartanu a jeho aktivního metabolitu jsou u starších a mladých hypertoniků podobné. Plazmatické koncentrace losartanu byly u žen s hypertenzí asi dvakrát vyšší než u hypertoniků mužů, ale koncentrace aktivního metabolitu byly u mužů a žen podobné.
Závod
Farmakokinetické rozdíly způsobené rasou nebyly studovány [viz také Použití u konkrétních populací ].
Jaterní nedostatečnost
Po perorálním podání pacientům s mírnou až středně těžkou alkoholickou cirhózou jater byly plazmatické koncentrace losartanu a jeho aktivního metabolitu 5krát vyšší, respektive přibližně 1,7krát vyšší než u mladých dobrovolníků mužského pohlaví. Ve srovnání s normálními subjekty byla celková plazmatická clearance losartanu u pacientů s jaterní insuficiencí asi o 50 % nižší a perorální biologická dostupnost byla asi dvojnásobná. Nižší počáteční dávku losartanu doporučenou pro použití u pacientů s poruchou funkce jater nelze pomocí přípravku HYZAAR podat. Jeho použití u těchto pacientů jako prostředku titrace losartanu se proto nedoporučuje [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a Použití u konkrétních populací ].
Renální insuficience
losartan
Po perorálním podání jsou plazmatické koncentrace a AUC losartanu a jeho aktivního metabolitu zvýšeny o 50-90 % u pacientů s mírnou (clearance kreatininu 50 až 74 ml/min) nebo středně těžkou (clearance kreatininu 30 až 49 ml/min) renální insuficiencí. V této studii byla renální clearance snížena o 55-85 % pro bothlosartan a jeho aktivní metabolit u pacientů s mírnou nebo středně těžkou renální insuficiencí. Losartan ani jeho aktivní metabolit nelze odstranit hemodialýzou.
hydrochlorothiazid
Po perorálním podání se AUC hydrochlorothiazidu zvýší o 70 % u pacientů s mírnou a středně těžkou renální insuficiencí o 700 %. V této studii se renální clearance hydrochlorothiazidu snížila o 45 % u pacientů s mírnou a středně těžkou poruchou funkce ledvin o 85 %.
Používejte obvyklé režimy léčby přípravkem HYZAAR, dokud je clearance kreatininu pacienta vyšší než 30 ml/min. Bezpečnost a účinnost HYZAAR 12,5 mg hospitalizovaných pacientů s těžkou poruchou funkce ledvin (clearance kreatininu nižší než 30 ml/min) nebyla stanovena (viz Použití u konkrétních populací ].
Lékové interakce
Losartan draselný
Ve studiích draselné soli losartanu s hydrochlorothiazidem, digoxinem, warfarinem, cimetidinem a fenobarbitalem nebyly zjištěny žádné klinicky významné lékové interakce. Bylo však prokázáno, že rifampin snižuje AUC losartanu a jeho aktivního metabolitu o 30 % a 40 %. Flukonazol, inhibitor cytochromu P450 2C9, po opakovaných dávkách snížil AUC aktivního metabolitu přibližně o 40 %, ale zvýšil AUC losartanu přibližně o 70 %. Konverze losartanu na jeho aktivní metabolit po intravenózním podání není ovlivněna ketokonazolem, inhibitorem P450 3A4. AUC aktivního metabolitu po perorálním losartanu nebyla ovlivněna erythromycinem, inhibitorem P450 3A4, ale AUC losartanu byla zvýšena 30 %.
Farmakodynamické důsledky současného užívání losartanu a inhibitorů P450 2C9 nebyly zkoumány. U jedinců, kteří nemetabolizují losartan na aktivní metabolit, bylo prokázáno, že mají specifický, vzácný defekt v cytochromu P450 2C9. Tyto údaje naznačují, že konverze losartanu na jeho aktivní metabolit je zprostředkována primárně P450 2C9 a nikoli P450 3A4.
Klinické studie
Losartan Monoterapie
Snížení rizika mrtvice
Studie LIFE byla mnohonárodní, dvojitě zaslepená studie srovnávající losartan a atenolol u 9193 hypertoniků s hypertrofií levé komory zdokumentovanou na EKG. Pacienti s infarktem myokardu nebo cévní mozkovou příhodou během šesti měsíců před randomizací byli vyloučeni. Pacienti byli randomizováni tak, aby dostávali jednou denně losartan 50 mg nebo atenolol 50 mg. Pokud nebylo dosaženo cílového krevního tlaku (
Ve snaze kontrolovat krevní tlak byl pacientům v obou větvích studie LIFE současně podáván hydrochlorothiazid po většinu doby, kdy byli na studovaném léku (73,9 % a 72,4 % dnů ve větvi s losartanem a atenololem, v daném pořadí).
randomizovaných pacientů bylo 4963 (54 %) žen a 533 (6 %) černochů. Průměrný věk byl 67 s 5 704 (62 %) věkem ≥ 65. Na začátku mělo 1195 (13 %) diabetes, 1326 (14 %) izolovanou systolickou hypertenzi, 1469 (16 %) koronární srdeční onemocnění a 728 (8 %) cerebrovaskulární onemocnění. Výchozí průměrný krevní tlak byl 174/98 mmHg v obou léčebných skupinách. Průměrná délka sledování byla 4,8 roku. Na konci studie nebo při poslední návštěvě před primárním cílovým parametrem 77 % ze skupiny léčené losartanem a 73 % ze skupiny léčené atenololem stále užívalo studijní medikaci. Z pacientů, kteří stále užívali studijní medikaci, byly průměrné dávky oflosartanu a atenololu obě asi 80 mg/den a 15 % užívalo atenolol nebo losartan jako monoterapii, zatímco 77 % dostávalo také hydrochlorothiazid (v průměrné dávce 20 mg/den v každá skupina). Snížení krevního tlaku měřené na konci dne bylo podobné pro obě léčebné skupiny, ale krevní tlak nebyl měřen v žádnou jinou denní dobu. Na konci studie nebo při poslední návštěvě před primárním koncovým bodem byly průměrné krevní tlaky 144,1/81,3 mmHg pro skupinu léčenou losartanem a 145,4/80,9 mmHg pro skupinu léčenou atenololem [rozdíl v SBP 1,3 mmHg byl signifikantní (p
Primárním cílovým parametrem byl první výskyt kardiovaskulárního úmrtí, nefatální cévní mozkové příhody nebo nefatálního infarktu myokardu. Pacienti s nefatálními příhodami zůstali ve studii, takže byla také vyšetřena první příhoda každého typu, i když se nejednalo o první příhodu (např. mrtvice po počátečním infarktu myokardu by byla započítána do analýzy mrtvice) . Léčba losartanem vedla k 13% snížení (p=0,021) rizika primárního cílového ukazatele ve srovnání se skupinou s atenololem; tento rozdíl byl primárně výsledkem vlivu na fatální a nefatální mrtvici. Léčba losartanem snížila riziko cévní mozkové příhody o 25 % ve srovnání s atenololem (p=0,001).
Losartan draselný-hydrochlorothiazid
kontrolované studie losartanu a hydrochlorothiazidu zahrnovaly více než 1300 pacientů, kteří hodnotili antihypertenzní účinnost různých dávek losartanu (25, 50 a 100 mg) a současně podávaného hydrochlorothiazidu (6,25, 12,5 a 25 mg). Faktoriální studie porovnávala kombinaci losartan/hydrochlorothiazid 50/12,5 mg s jeho složkami a placebem. Kombinace losartan/hydrochlorothiazid 50/12,5 mg vedla k přibližně aditivní systolické/diastolikreční odpovědi upravené na placebo (15,5/9,0 mmHg pro kombinaci ve srovnání s 8,5/5,0 mmHg pro samotný losartan a 7,0/3,0 mmHg pro hydrochlorothiazid). Další studie zkoumala vztah mezi dávkou a odezvou různých dávek hydrochlorothiazidu (6,25, 12,5 a 25 mg) nebo placeba na pozadí losartanu (50 mg) u pacientů, kteří nejsou adekvátně kontrolováni (diastolický krevní tlak vsedě [SiDBP] 93-120 mmHg) na samotný losartan (50 mg). Třetí studie zkoumala vztah mezi dávkou a odezvou různých dávek losartanu (25, 50 a 100 mg) nebo placeba na pozadí hydrochlorothiazidu (25 mg) u pacientů s nedostatečnou kontrolou (SiDBP93-120 mmHg) na hydrochlorothiazidu (25 mg) sám. Tyto studie prokázaly dodatečnou antihypertenzní odpověď na konci účinku (24 hodin po podání) hydrochlorothiazidu 12,5 nebo 25 mg přidaného k 50 mg losartanu 5,5/3,5 a 10,0/6,0 mmHg, v daném pořadí. Podobně došlo k dodatečné antihypertenzní odpovědi, když byl losartan 50 nebo 100 mg přidán k hydrochlorothiazidu 25 mg 9,0/5,5 a 12,5/6,5 mmHg, v daném pořadí. Nebyl žádný významný vliv na srdeční frekvenci.
Nebyl žádný rozdíl v odpovědi u mužů a žen nebo u pacientů starších nebo mladších 65 let.
Černošští pacienti měli větší odpověď na hydrochlorothiazid než pacienti jiné rasy a menší odpověď na losartan. Celková odpověď na kombinaci byla podobná u černošských a nečerných pacientů.
Těžká hypertenze (SiDBP ≥110 mmHg)
Bezpečnost a účinnost přípravku HYZAAR jako počáteční terapie těžké hypertenze (definované jako průměrný SiDBP ≥110 mmHg potvrzený při 2 různých příležitostech bez jakékoli antihypertenzní terapie) byla studována v 6týdenní dvojitě zaslepené, randomizované, multicentrické studii. Pacienti byli randomizováni buď k losartanu a hydrochlorothiazidu (50/12,5 mg, jednou denně) nebo k losartanu (50 mg, jednou denně) a byli sledováni podle odpovědi krevního tlaku. Pacienti byli titrováni ve 2týdenních intervalech, pokud jejich SiDBP nedosáhl cíle (
Do studie bylo zařazeno 585 pacientů, včetně 264 (45 %) žen, 124 (21 %) černochů a 21 (4 %) ve věku ≥ 65 let. Průměrný krevní tlak na začátku pro celou populaci byl 171/113 mmHg. Průměrný věk byl 53 let. Po 4 týdnech terapie byl průměrný SiDBP o 3,1 mmHg nižší a průměrný SiSBP byl o 5,6 mmH nižší ve skupině léčené přípravkem HYZAAR. V důsledku toho větší část pacientů užívajících HYZAAR 12,5 mg dosáhla cílového diastolického krevního tlaku (17,6 % pro HYZAAR 12,5 mg, 9,4 % pro losartan; p=0,006). Podobné trendy byly pozorovány, když byli pacienti seskupeni podle pohlaví, rasy nebo věku (
Po 6 týdnech terapie dosáhlo cílového diastolického krevního tlaku více pacientů, kteří dostávali kombinovaný režim, než ti, kteří dostávali režim monoterapie (29,8 % oproti 12,5 %).
INFORMACE PRO PACIENTA
HYZAAR® (HY-zar) (draselná sůl losartanu a tablety hydrochlorothiazidu) 50/12,5 mg, 100/12,5 mg, 100/25 mg
Přečtěte si informace pro pacienty, které jsou součástí HYZAAR ®, než jej začnete užívat, a pokaždé, když dostanete náplň. Mohou se objevit nové informace. Tato příbalová informace nenahrazuje rozhovor s lékařem o vašem stavu a léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o HYZAAR?
- HYZAAR může způsobit poškození nebo smrt nenarozeného dítěte.
- Pokud plánujete otěhotnět, poraďte se se svým lékařem o dalších způsobech, jak snížit krevní tlak.
- Pokud otěhotníte během užívání přípravku HYZAAR 12,5 mg, okamžitě to sdělte svému lékaři.
Co je HYZAAR 12,5 mg?
HYZAAR 12,5 mg obsahuje 2 léky na předpis, blokátor receptorů pro angiotenzin (ARB) a diuretikum (pilulku na odvodnění). Používá se k:
- nižší vysoký krevní tlak (hypertenze). HYZAAR obvykle není prvním lékem používaným k léčbě vysokého krevního tlaku.
- snížit pravděpodobnost cévní mozkové příhody u pacientů s vysokým krevním tlakem a srdečním problémem zvaným hypertrofie levé komory (LVH). HYZAAR nemusí černošským pacientům s tímto problémem pomoci.
HYZAAR nebyl studován u dětí mladších 18 let.
Vysoký krevní tlak (hypertenze). Krevní tlak je síla ve vašich krevních cévách, když vaše srdce bije a když vaše srdce odpočívá. Máte vysoký krevní tlak, když je síla příliš velká. Složka losartanu v přípravku HYZAAR 12,5 mg může pomoci uvolnit vaše krevní cévy, takže váš krevní tlak je nižší. Hydrochlorothiazid v gredientinu HYZAAR působí tak, že ledvinami propouští více vody a soli.
Hypertrofie levé komory (LVH) je zvětšení stěn levé komory srdce (hlavní čerpací komory srdce). LVH může nastat z několika věcí. Vysoký krevní tlak je nejčastější příčinou LVH.
Kdo by neměl užívat HYZAAR?
Neužívejte HYZAAR 12,5 mg, jestliže:
- jsou alergičtí na jakoukoli složku přípravku HYZAAR. Podívejte se na úplný seznam složek přípravku HYZAAR na konci této příbalové informace.
- nevylučují moč.
- máte cukrovku a užíváte lék zvaný aliskiren ke snížení krevního tlaku.
Co mám říci svému lékaři, než začnu užívat přípravek HYZAAR?
Informujte svého lékaře o všech svých zdravotních stavech, včetně toho, zda:
- jste těhotná nebo těhotenství plánujete. Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o HYZAAR?"
- kojíte nebo plánujete kojit. HYZAAR může přecházet do vašeho mléka a může poškodit vaše dítě. Vy a váš lékař byste se měli rozhodnout, zda budete přípravek HYZAAR užívat nebo kojit. Neměli byste dělat obojí.
- jste zvracel (zvracel), měl průjem, hodně se potil nebo nepil dostatek tekutin. Ty mohou způsobit, že budete mít nízký krevní tlak.
- mít problémy s játry
- mít problémy s ledvinami
- máte systémový lupus erythematodes (Lupus; SLE)
- mít cukrovku
- trpět dnou
- mít nějaké alergie
- jste měl/a rakovinu kůže nebo pokud se u Vás během léčby objeví nová kožní léze. Léčba hydrochlorothiazidem může zvýšit riziko některých typů rakoviny kůže (nemelanomová rakovina kůže). Prodiskutujte se svým lékařem, jak chránit pokožku před slunečním zářením a jak často byste měli podstupovat screening rakoviny kůže.
Informujte svého lékaře o všech lécích, které užíváte, včetně léků na předpis i bez předpisu, vitamínů a bylinných doplňků.
HYZAAR 12,5 mg a některé další léky se mohou vzájemně ovlivňovat. Zejména informujte svého lékaře, pokud užíváte:
- doplňky draslíku
- náhražky soli obsahující draslík
- jiné léky, které mohou zvýšit hladinu draslíku v séru
- pilulky na vodu (diuretika)
- lithium (lék používaný k léčbě určitého druhu deprese)
- léky používané k léčbě bolesti a artritidy, nazývané nesteroidní protizánětlivé léky (NSAID), včetně inhibitorů COX-2
- jiné léky na snížení krevního tlaku.
Znát léky, které užíváte. Uchovávejte si seznam svých léků a ukažte jej svému lékaři a lékárníkovi, když dostanete nový lék.
Jak mám užívat HYZAAR 12,5 mg?
- Užívejte HYZAAR 12,5 mg přesně podle pokynů svého lékaře. Váš lékař může v případě potřeby změnit dávku.
- HYZAAR lze užívat s jídlem nebo bez jídla.
- Pokud vynecháte dávku, užijte ji, jakmile si vzpomenete. Pokud se blížíte k další dávce, zapomenutou dávku neužívejte. Užijte si další dávku v obvyklou dobu.
- Jestliže užijete příliš mnoho přípravku HYZAAR 12,5 mg, zavolejte svého lékaře nebo Toxikologické středisko nebo jděte ihned na pohotovost v nejbližší nemocnici.
- Váš lékař může čas od času provádět krevní testy, když užíváte přípravek HYZAAR.
Jaké jsou možné vedlejší účinky přípravku HYZAAR?
HYZAAR může způsobit následující nežádoucí účinky, které mohou být závažné:
- Zranění nebo smrt nenarozených dětí. Viz "Jaké jsou nejdůležitější informace, které bych měl vědět o HYZAAR?"
- Alergická reakce. Příznaky alergické reakce jsou otok obličeje, rtů, hrdla nebo jazyka. Okamžitě vyhledejte lékařskou pomoc a přestaňte přípravek HYZAAR užívat.
- Nízký krevní tlak (hypotenze). Nízký krevní tlak může způsobit pocit na omdlení nebo závratě. Lehněte si, pokud máte pocit na omdlení nebo závratě. Okamžitě zavolejte svému lékaři.
- Pokud máte problémy s ledvinami, můžete zaznamenat zhoršení funkce ledvin. Zavolejte svého lékaře, pokud máte otoky nohou, kotníků nebo rukou nebo nevysvětlitelné zvýšení hmotnosti.
- Nový nebo zhoršující se stav nazývaný systémový lupus erythematodes (Lupus; SLE)
- Oční problémy. Jeden z léků v přípravku HYZAAR 12,5 mg může způsobit oční problémy, které, pokud se neléčí, mohou vést ke ztrátě zraku. Příznaky očních problémů se mohou objevit během hodin až týdnů po zahájení léčby přípravkem HYZAAR. Okamžitě informujte svého lékaře, pokud máte:
- snížení vidění
- bolest očí
- Citlivost kůže na slunce a riziko rakoviny kůže.
Nejčastějšími nežádoucími účinky přípravku HYZAAR 12,5 mg u lidí s vysokým krevním tlakem jsou:
- „nachlazení“ (infekce horních cest dýchacích)
- závrať
- ucpaný nos
- bolesti zad
Informujte svého lékaře, pokud zaznamenáte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který nezmizí. Toto není úplný seznam vedlejších účinků. Úplný seznam získáte od svého lékaře nebo lékárníka.
Jak mám uchovávat HYZAAR 12,5 mg?
- Skladujte HYZAAR při pokojové teplotě při 59°F až 86°F (15°C až 30°C).
- Uchovávejte HYZAAR v těsně uzavřené nádobě a HYZAAR uchovávejte mimo světlo.
- Uchovávejte HYZAAR 12,5 mg a všechny léky mimo dosah dětí.
Obecné informace o HYZAAR
Léky jsou někdy předepisovány na stavy, které nejsou uvedeny v příbalových informacích pro pacienty. Nepoužívejte HYZAAR pro stav, pro který nebyl předepsán. Nedávejte HYZAAR jiným lidem, i když mají stejné příznaky jako vy. Může jim to ublížit.
Tento leták shrnuje nejdůležitější informace o HYZAAR. Pokud chcete více informací, promluvte si se svým lékařem. Můžete požádat svého lékárníka nebo lékaře o informace, které jsou určeny pro zdravotníky.
Jaké jsou složky přípravku HYZAAR?
Účinné látky: losartan draselný, hydrochlorothiazid
Neaktivní složky:
mikrokrystalická celulóza, hydratovaná laktóza, předbobtnalý škrob, magnesium-stearát, hydroxypropylcelulóza, hypromelóza, oxid titaničitý. HYZAAR 50/12,5 a HYZAAR 100/25 také obsahují D&C žlutý č. 10 hliníkový lak.
HYZAAR 50/12,5, HYZAAR 100/12,5 a HYZAAR 100/25 mohou také obsahovat karnaubský vosk.
