Vasotec 2.5mg, 5mg, 10mg Enalapril Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Vasotec a jak se používá?
Vasotec je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze), dysfunkce levé komory a městnavého srdečního selhání. Vasotec lze užívat samostatně nebo s jinými léky.
- Vasotec patří do třídy léků nazývaných ACE inhibitory.
- Není známo, zda je přípravek Vasotec bezpečný a účinný u dětí mladších 1 měsíce.
Jaké jsou možné vedlejší účinky přípravku Vasotec 2,5 mg?
Vasotec 2,5 mg může způsobit závažné nežádoucí účinky, včetně:
- točení hlavy,
- bolest na hrudi,
- zežloutnutí kůže nebo očí (žloutenka),
- malé nebo žádné močení,
- horečka,
- zimnice,
- bolest krku,
- nevolnost,
- slabost,
- štiplavý pocit,
- nepravidelný srdeční tep a
- ztráta pohybu
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Vasotec patří:
- závrať,
- únava a
- točení hlavy
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky přípravku Vasotec. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
- Při zjištění těhotenství přerušte co nejdříve VASOTEC®.
- Léky, které působí přímo na renin-angiotensinový systém, mohou způsobit poranění a smrt vyvíjejícího se plodu. Viz VAROVÁNÍ: Fetální toxicita
POPIS
VASOTEC® (Enalapril Maleate) je maleátová sůl enalaprilu, ethylesteru dlouhodobě působícího inhibitoru angiotensin-konvertujícího enzymu, enalaprilátu. Enalapril maleát je chemicky popsán jako (S)-l[N-[l-(ethoxykarbonyl)-3-fenylpropyl]-L-alanyl]-L-prolin, (Z)-2-butendioátová sůl (1:1). Jeho empirický vzorec je C20H28N2O5•C4H4O4 a jeho strukturní vzorec je:
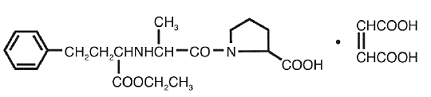
Enalapril maleát je bílý až téměř bílý krystalický prášek s molekulovou hmotností 492,53. Je těžce rozpustný ve vodě, rozpustný v ethanolu a volně rozpustný v methanolu.
Enalapril je proléčivo; po perorálním podání je bioaktivován hydrolýzou ethylesteru na enalaprilát, což je aktivní inhibitor enzymu konvertujícího angiotensin.
Enalapril maleát se dodává jako 2,5 mg, 5 mg, 10 mg a 20 mg tablety pro perorální podání. Kromě účinné látky enalapril maleát obsahuje každá tableta následující neaktivní složky: laktózu, stearát hořečnatý, hydrogenuhličitan sodný a škrob. Tablety 10 mg a 20 mg také obsahují oxidy železa.
INDIKACE
Hypertenze
VASOTEC je indikován k léčbě hypertenze.
VASOTEC je účinný samostatně nebo v kombinaci s jinými antihypertenzivy, zejména thiazidovými diuretiky. Účinky přípravku VASOTEC 10 mg a thiazidů na snížení krevního tlaku jsou přibližně aditivní.
Srdeční selhání
VASOTEC je indikován k léčbě symptomatického městnavého srdečního selhání, obvykle v kombinaci s diuretiky a digitalisem. U těchto pacientů VASOTEC 5 mg zlepšuje příznaky, prodlužuje přežití a snižuje frekvenci hospitalizací (viz KLINICKÁ FARMAKOLOGIE , Srdeční selhání , Zkoušky úmrtnosti pro podrobnosti a omezení zkoušek přežití ).
Asymptomatická dysfunkce levé komory
klinicky stabilních asymptomatických pacientů s dysfunkcí levé komory (ejekční frakce ≤ 35 procent) snižuje VASOTEC 5 mg rychlost rozvoje zjevného srdečního selhání a snižuje výskyt hospitalizací pro srdeční selhání (viz KLINICKÁ FARMAKOLOGIE , Srdeční selhání , Zkoušky úmrtnosti pro podrobnosti a omezení zkoušek přežití ).
Při používání VASOTEC 2,5 mg je třeba vzít v úvahu skutečnost, že jiný inhibitor angiotenzin konvertujícího enzymu, kaptopril, způsobil agranulocytózu, zejména u pacientů s poruchou ledvin nebo kolagenovým vaskulárním onemocněním, a že dostupné údaje nejsou dostatečné k prokázání, že VASOTEC 2,5 mg nezpůsobuje mají podobné riziko (viz VAROVÁNÍ ).
Při zvažování použití VASOTECu je třeba poznamenat, že v kontrolovaných klinických studiích mají ACE inhibitory účinek na krevní tlak, který je u černošských pacientů menší než u jiných než černochů. Kromě toho je třeba poznamenat, že u pacientů černé pleti užívajících inhibitory ACE byl hlášen vyšší výskyt angioedému ve srovnání s pacienty jiné rasy (viz VAROVÁNÍ , Angioedém hlavy a krku ).
DÁVKOVÁNÍ A PODÁVÁNÍ
Hypertenze
U pacientů, kteří jsou v současné době léčeni diuretiky, se po úvodní dávce přípravku VASOTEC může příležitostně objevit symptomatická hypotenze. Diuretikum by mělo být pokud možno vysazeno na dva až tři dny před zahájením léčby přípravkem VASOTEC, aby se snížila pravděpodobnost hypotenze (viz VAROVÁNÍ ). Pokud není krevní tlak pacienta kontrolován samotným přípravkem VASOTEC, může být léčba diuretiky obnovena.
Pokud nelze diuretikum vysadit, měla by být pod lékařským dohledem použita počáteční dávka 2,5 mg po dobu nejméně dvou hodin a dokud se krevní tlak nestabilizuje po dobu nejméně další hodiny (viz VAROVÁNÍ a OPATŘENÍ , DROGOVÉ INTERAKCE ).
Doporučená počáteční dávka u pacientů, kteří neužívají diuretika, je 5 mg jednou denně. Dávkování by mělo být upraveno podle reakce krevního tlaku. Obvyklé rozmezí dávek je 10 až 40 mg denně podávaných v jedné dávce nebo ve dvou rozdělených dávkách. U některých pacientů léčených jednou denně se může antihypertenzní účinek ke konci dávkovacího intervalu snižovat. U takových pacientů je třeba zvážit zvýšení dávky nebo podávání dvakrát denně. Pokud není krevní tlak kontrolován samotným přípravkem VASOTEC 2,5 mg, může být přidáno diuretikum. Současné podávání přípravku VASOTEC 5 mg s doplňky draslíku, náhradami draslíkové soli nebo diuretiky šetřícími draslík může vést ke zvýšení sérového draslíku (viz OPATŘENÍ ).
Úprava dávkování u hypertenzních pacientů s poruchou funkce ledvin
Obvyklá dávka enalaprilu se doporučuje u pacientů s clearance kreatininu vyšší než 30 ml/min (sérový kreatinin do přibližně 3 mg/dl). U pacientů s clearance kreatininu nižší nebo rovnou 30 ml/min (sérový kreatinin vyšší nebo rovný 3 mg/dl) je první dávka 2,5 mg jednou denně. Dávka může být titrována směrem nahoru, dokud není krevní tlak kontrolován, nebo na maximum 40 mg denně.
Srdeční selhání
VASOTEC je indikován k léčbě symptomatického srdečního selhání, obvykle v kombinaci s diuretiky a digitalisem. V placebem kontrolovaných studiích, které prokázaly zlepšené přežití, byla pacientům titrována podle tolerované dávky až do 40 mg, podávaných ve dvou dílčích dávkách.
Doporučená počáteční dávka je 2,5 mg. Doporučené rozmezí dávkování je 2,5 až 20 mg podávaných dvakrát denně. Dávky by měly být titrovány směrem nahoru, jak je tolerováno, po dobu několika dnů nebo týdnů. Maximální denní dávka podávaná v klinických studiích byla 40 mg v rozdělených dávkách.
Po úvodní dávce přípravku VASOTEC by měl být pacient sledován pod lékařským dohledem po dobu nejméně dvou hodin a dokud se krevní tlak nestabilizuje po dobu nejméně další hodiny (viz VAROVÁNÍ a DROGOVÉ INTERAKCE ). Pokud je to možné, měla by být snížena dávka jakéhokoli současně podávaného diuretika, což může snížit pravděpodobnost hypotenze. Výskyt hypotenze po úvodní dávce přípravku VASOTEC nevylučuje následnou pečlivou titraci dávky léku po účinném zvládnutí hypotenze.
Asymptomatická dysfunkce levé komory
Ve studii, která prokázala účinnost, byla u pacientů zahájena dávka 2,5 mg dvakrát denně a byla titrována podle snášenlivosti na cílovou denní dávku 20 mg (v rozdělených dávkách).
Po úvodní dávce VASOTEC 10 mg by měl být pacient sledován pod lékařským dohledem po dobu nejméně dvou hodin a dokud se krevní tlak nestabilizuje po dobu nejméně další hodiny (viz VAROVÁNÍ a DROGOVÉ INTERAKCE ). Pokud je to možné, měla by být snížena dávka jakéhokoli současně podávaného diuretika, což může snížit pravděpodobnost hypotenze. Výskyt hypotenze po úvodní dávce přípravku VASOTEC 5 mg nevylučuje následnou pečlivou titraci dávky léku po účinném zvládnutí hypotenze.
Úprava dávkování u pacientů se srdečním selháním a renálním poškozením nebo hyponatrémií
U pacientů se srdečním selháním, kteří mají hyponatrémii (sodík v séru nižší než 130 mEq/l) nebo se sérovým kreatininem vyšším než 1,6 mg/dl, by měla být léčba zahájena dávkou 2,5 mg denně pod pečlivým lékařským dohledem (viz Srdeční selhání , VAROVÁNÍ a DROGOVÉ INTERAKCE ). Dávka může být zvýšena na 2,5 mg dvakrát denně, poté 5 mg dvakrát denně a vyšší podle potřeby, obvykle v intervalech čtyř dnů nebo více, pokud v době úpravy dávky nedojde k nadměrné hypotenzi nebo významnému zhoršení funkce ledvin. Maximální denní dávka je 40 mg.
Dětští hypertonici
Obvyklá doporučená počáteční dávka je 0,08 mg/kg (až 5 mg) jednou denně. Dávkování by mělo být upraveno podle reakce krevního tlaku. Dávky nad 0,58 mg/kg (nebo vyšší než 40 mg) nebyly u pediatrických pacientů studovány (viz KLINICKÁ FARMAKOLOGIE , Klinická farmakologie u dětských pacientů ).
VASOTEC 5 mg se nedoporučuje u novorozenců a dětských pacientů s rychlostí glomerulární filtrace nižší než 30 ml/min/1,73 m², protože nejsou k dispozici žádné údaje.
Příprava suspenze (pro 200 ml suspenze 1,0 mg/ml)
Přidejte 50 ml Bicitra® do polyethylentereftalátové (PET) lahvičky obsahující deset 20mg tablet VASOTEC 10mg a protřepávejte alespoň 2 minuty. Koncentrát nechte stát 60 minut. Po uplynutí doby 60 minut protřepejte koncentrát další minutu. Přidejte 150 ml Ora-Sweet SF™2 ke koncentrátu v PET lahvi a protřepejte suspenzi, aby se přísady dispergovaly. Suspenze by měla být chlazena při 2-8°C (36-46°F) a může být skladována po dobu až 30 dnů. Před každým použitím suspenzi protřepejte.
JAK DODÁVÁNO
Úložný prostor
Skladujte při teplotě 25 °C (77 °F); povoleny výchylky do 15-30°C (59-86°F) [viz USP řízená pokojová teplota ].
Nádobu uchovávejte těsně uzavřenou.
Chraňte před vlhkostí.
Vydávejte v těsné nádobě podle USP, pokud je balení produktu rozděleno.
Vyrobeno pro: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Výrobce: Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Kanada. Revize: červenec 2017.
VEDLEJŠÍ EFEKTY
Bezpečnost přípravku VASOTEC byla hodnocena u více než 10 000 pacientů, včetně více než 1 000 pacientů léčených po dobu jednoho roku nebo déle. V kontrolovaných klinických studiích zahrnujících 2987 pacientů bylo zjištěno, že VASOTEC 10 mg je obecně dobře snášen. Nežádoucí účinky byly většinou mírné a přechodné povahy. V klinických studiích bylo nutné přerušení terapie z důvodu klinických nežádoucích účinků u 3,3 procenta pacientů s hypertenzí a u 5,7 procenta pacientů se srdečním selháním. Četnost nežádoucích účinků nesouvisela s celkovou denní dávkou v rámci obvyklých dávkovacích rozmezí. U pacientů s hypertenzí bylo celkové procento pacientů léčených přípravkem VASOTEC hlásících nežádoucí účinky srovnatelné s placebem.
Hypertenze
Nežádoucí účinky vyskytující se u více než jednoho procenta pacientů s hypertenzí léčených přípravkem VASOTEC 2,5 mg v kontrolovaných klinických studiích jsou uvedeny níže. U pacientů léčených přípravkem VASOTEC byla maximální délka léčby tři roky; u pacientů léčených placebem byla maximální délka léčby 12 týdnů.
Srdeční selhání
Nežádoucí účinky vyskytující se u více než jednoho procenta pacientů se srdečním selháním léčených přípravkem VASOTEC 5 mg jsou uvedeny níže. Incidence představují zkušenosti z kontrolovaných i nekontrolovaných klinických studií (maximální délka léčby byla přibližně jeden rok). U pacientů léčených placebem jsou hlášené výskyty z kontrolovaných studií (maximální délka léčby je 12 týdnů). Procento pacientů se závažným srdečním selháním (třída IV NYHA) bylo 29 procent a 43 procent u pacientů léčených přípravkem VASOTEC 2,5 mg a placebem.
Další závažné klinické nežádoucí účinky vyskytující se od uvedení léku na trh nebo nežádoucí účinky vyskytující se u 0,5 až 1,0 procenta pacientů s hypertenzí nebo srdečním selháním v klinických studiích jsou uvedeny níže a v každé kategorii jsou seřazeny podle klesající závažnosti.
Tělo Jako celek
Anafylaktoidní reakce (viz VAROVÁNÍ , Anafylaktoidní a možná související reakce ).
Kardiovaskulární
Srdeční zástava; infarkt myokardu nebo cerebrovaskulární příhoda, pravděpodobně sekundární k nadměrné hypotenzi u vysoce rizikových pacientů (viz VAROVÁNÍ , Hypotenze ); plicní embolie a infarkt; plicní otok; poruchy rytmu včetně síňové tachykardie a bradykardie; fibrilace síní; palpitace, Raynaudův fenomén.
Zažívací
Ileus, pankreatitida, jaterní selhání, hepatitida (hepatocelulární [prokázáno při opakovaném podání] nebo cholestatická žloutenka) (viz VAROVÁNÍ , Jaterní selhání ), melena, anorexie, dyspepsie, zácpa, glositida, stomatitida, sucho v ústech.
Hematologické
Vzácné případy neutropenie, trombocytopenie a útlumu kostní dřeně.
Muskuloskeletální
Svalové křeče.
Nervózní/psychiatrický
Deprese, zmatenost, ataxie, somnolence, nespavost, nervozita, periferní neuropatie (např. parestézie, dysestézie), abnormální sny.
Respirační
Bronchospasmus, rinorea, bolest v krku a chrapot, astma, infekce horních cest dýchacích, plicní infiltráty, eozinofilní pneumonitida.
Kůže
Exfoliativní dermatitida, toxická epidermální nekrolýza, Stevens-Johnsonův syndrom, pemfigus, pásový opar, erythema multiforme, kopřivka, pruritus, alopecie, zrudnutí, pocení, fotosenzitivita.
Speciální smysly
Rozmazané vidění, změna chuti, anosmie, tinitus, konjunktivitida, suché oči, slzení.
Urogenitální
Renální selhání, oligurie, renální dysfunkce (viz OPATŘENÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ), bolest v boku, gynekomastie, impotence.
Smíšený
Byl hlášen komplex symptomů, který může zahrnovat některé nebo všechny z následujících: pozitivní ANA, zvýšená sedimentace erytrocytů, artralgie/artritida, myalgie/myositida, horečka, serozitida, vaskulitida, leukocytóza, eozinofilie, fotosenzitivita, vyrážka a další dermatologické projevy.
Angioedém
Angioedém byl hlášen u pacientů užívajících VASOTEC 2,5 mg s vyšší incidencí u černochů než u pacientů jiné rasy. Angioedém spojený s laryngeálním edémem může být fatální. Pokud se objeví angioedém obličeje, končetin, rtů, jazyka, hlasivkové štěrbiny a/nebo hrtanu, je třeba léčbu přípravkem VASOTEC přerušit a okamžitě zahájit vhodnou léčbu (viz VAROVÁNÍ ).
Hypotenze
hypertoniků se hypotenze vyskytla u 0,9 % a synkopa u 0,5 % pacientů po úvodní dávce nebo během prodloužené léčby. Hypotenze nebo synkopa byly důvodem k přerušení léčby u 0,1 procenta pacientů s hypertenzí. U pacientů se srdečním selháním se hypotenze vyskytla u 6,7 procenta a synkopa u 2,2 procenta pacientů. Hypotenze nebo synkopa byly příčinou přerušení léčby u 1,9 procenta pacientů se srdečním selháním (viz VAROVÁNÍ ).
Kašel
Vidět OPATŘENÍ , Kašel .
Pediatričtí pacienti
Profil nežádoucích účinků u pediatrických pacientů se zdá být podobný jako u dospělých pacientů.
Výsledky klinických laboratorních testů
Sérové elektrolyty
Hyperkalémie (viz OPATŘENÍ ), hyponatrémie.
Kreatinin, dusík močoviny v krvi
kontrolovaných klinických studiích bylo pozorováno mírné zvýšení dusíku močoviny v krvi a sérového kreatininu, reverzibilní po přerušení léčby, u asi 0,2 procenta pacientů s esenciální hypertenzí léčených samotným přípravkem VASOTEC. Zvýšení je pravděpodobnější u pacientů užívajících současně diuretika nebo u pacientů se stenózou renální arterie (viz OPATŘENÍ ). U pacientů se srdečním selháním, kteří také užívali diuretika s digitalisem nebo bez něj, bylo u přibližně 11 procent pacientů pozorováno zvýšení dusíku močoviny v krvi nebo sérového kreatininu, obvykle reverzibilní po přerušení léčby přípravkem VASOTEC 5 mg a/nebo jiné souběžné diuretické léčby. Zvýšení hladiny močovinového dusíku nebo kreatininu v krvi bylo důvodem k přerušení léčby u 1,2 procenta pacientů.
Hematologie
Malé snížení hemoglobinu a hematokritu (průměrné snížení přibližně o 0,3 g procenta a 1,0 objemového procenta, v uvedeném pořadí) se často vyskytuje u pacientů s hypertenzí nebo městnavým srdečním selháním léčených přípravkem VASOTEC 5 mg, ale zřídka má klinický význam, pokud se nevyskytuje současně jiná příčina anémie. V klinických studiích přerušilo léčbu kvůli anémii méně než 0,1 procenta pacientů. Byla hlášena hemolytická anémie, včetně případů hemolýzy u pacientů s deficitem G6PD; nelze vyloučit kauzální vztah k enalaprilu.
Testy jaterních funkcí
Došlo ke zvýšení jaterních enzymů a/nebo sérového bilirubinu (viz VAROVÁNÍ , Jaterní selhání ).
Chcete-li nahlásit PODezření na NEŽÁDOUCÍ REAKCE, kontaktujte společnost Valeant Pharmaceuticals North America LLC na čísle 1-800-321-4576 nebo FDA na čísle 1-800-FDA-1088 nebo www.fda.gov/medwatch.
DROGOVÉ INTERAKCE
Neprilysinové inhibitory
Pacienti užívající současně inhibitory neprilysinu mohou mít zvýšené riziko angioedému. (vidět VAROVÁNÍ )
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo aliskirenem je spojena se zvýšeným rizikem hypotenze, hyperkalemie a změn renálních funkcí (včetně akutního renálního selhání) ve srovnání s monoterapií. Většina pacientů užívajících kombinaci dvou inhibitorů RAS nezíská žádný další přínos ve srovnání s monoterapií. Obecně se vyhněte kombinovanému užívání inhibitorů RAS. Pečlivě sledujte krevní tlak, funkci ledvin a elektrolyty u pacientů užívajících VASOTEC 2,5 mg a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s přípravkem VASOTEC 5 mg pacientům s diabetem. Vyhněte se použití aliskirenu s přípravkem VASOTEC u pacientů s poruchou funkce ledvin (GFR
Hypotenze - Pacienti na diuretické terapii
pacientů užívajících diuretika a zvláště u těch, u kterých byla diuretická léčba nedávno zahájena, může příležitostně dojít k nadměrnému snížení krevního tlaku po zahájení léčby enalaprilem. Možnost hypotenzních účinků enalaprilu lze minimalizovat buď vysazením diuretika nebo zvýšením příjmu soli před zahájením léčby enalaprilem. Pokud je nutné pokračovat v diuretiku, zajistěte po úvodní dávce po dobu nejméně dvou hodin pečlivý lékařský dohled a dokud se krevní tlak nestabilizuje po dobu nejméně další hodiny (viz VAROVÁNÍ a DÁVKOVÁNÍ A PODÁVÁNÍ ).
Agenti způsobující uvolňování reninu
Antihypertenzní účinek přípravku VASOTEC 10 mg zesilují antihypertenziva, která způsobují uvolňování reninu (např. diuretika).
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2)
pacientů, kteří jsou starší, s deplecí objemu (včetně těch, kteří jsou léčeni diuretiky) nebo s oslabenou funkcí ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s ACE inhibitory, včetně enalaprilu, vést ke zhoršení renálních funkcí, včetně možné akutní selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů užívajících enalapril a NSAID pravidelně monitorujte renální funkce.
V klinické farmakologické studii byly pacientům s hypertenzí, kterým byl podáván VASOTEC, podávány indometacin nebo sulindac. V této studii nebyly žádné důkazy o oslabení antihypertenzního účinku přípravku VASOTEC. Zprávy však naznačují, že NSAID mohou snižovat antihypertenzní účinek inhibitorů ACE.
Jiné kardiovaskulární látky
VASOTEC 10 mg byl užíván současně s beta-adrenergními blokátory, methyldopou, nitráty, kalciovými blokátory, hydralazinem, prazosinem a digoxinem bez známek klinicky významných nežádoucích interakcí.
Činidla zvyšující sérový draslík
VASOTEC zmírňuje ztráty draslíku způsobené diuretiky thiazidového typu. Draslík šetřící diuretika (např. spironolakton, triamteren nebo amilorid), doplňky draslíku nebo náhražky soli obsahující draslík mohou vést k významnému zvýšení sérového draslíku. Pokud je tedy současné užívání těchto látek indikováno z důvodu prokázané hypokalémie, měly by být používány s opatrností a za častého monitorování sérového draslíku. Draslík šetřící přípravky by se obecně neměly používat u pacientů se srdečním selháním užívajících VASOTEC.
Lithium
Toxicita lithia byla hlášena u pacientů užívajících lithium současně s léky, které způsobují eliminaci sodíku, včetně ACE inhibitorů. U pacientů užívajících současně VASOTEC a lithium bylo hlášeno několik případů toxicity lithia, které byly po vysazení obou léků reverzibilní. Pokud je enalapril podáván současně s lithiem, doporučuje se často monitorovat hladiny lithia v séru.
Zlato
Nitritoidní reakce (příznaky zahrnují zčervenání obličeje, nauzeu, zvracení a hypotenzi) byly vzácně hlášeny u pacientů léčených injekčním zlatem (aurothiomalát sodný) a souběžnou léčbou inhibitory ACE včetně přípravku VASOTEC.
Inhibitory mTOR (Mammalian Target Of Rapamycin).
U pacientů užívajících současně inhibitor ACE a inhibitor mTOR (např. temsirolimus, sirolimus, everolimus) může být zvýšené riziko angioedému (viz VAROVÁNÍ ).
VAROVÁNÍ
Anafylaktoidní a možná související reakce
Pravděpodobně proto, že inhibitory angiotenzin-konvertujícího enzymu ovlivňují metabolismus eikosanoidů a polypeptidů, včetně endogenního bradykininu, mohou být pacienti užívající ACE inhibitory (včetně VASOTEC) vystaveni řadě nežádoucích reakcí, z nichž některé jsou závažné.
Angioedém hlavy a krku
Angioedém obličeje, končetin, rtů, jazyka, glottis a/nebo hrtanu byl hlášen u pacientů léčených inhibitory angiotenzin konvertujícího enzymu, včetně VASOTEC. K tomu může dojít kdykoli během léčby. V takových případech musí být VASOTEC 2,5 mg okamžitě vysazen a má být zajištěna vhodná léčba a sledování, dokud nedojde k úplnému a trvalému vymizení známek a příznaků. V případech, kdy se otok omezil na obličej a rty, se stav obecně vyřešil bez léčby, i když antihistaminika byla užitečná při zmírňování příznaků. Angioedém spojený s laryngeálním edémem může být fatální. případě postižení jazyka, hlasivkové štěrbiny nebo hrtanu, které pravděpodobně způsobí obstrukci dýchacích cest, by měla být neprodleně zahájena vhodná léčba, např. podkožní roztok epinefrinu 1:1000 (0,3 ml až 0,5 ml) a/nebo opatření nezbytná k zajištění průchodnosti dýchacích cest. pokud (vidět NEŽÁDOUCÍ REAKCE ).
Pacienti, kteří jsou současně léčeni inhibitorem ACE a inhibitorem mTOR (savčí cíl rapamycinu) (např. temsirolimus, sirolimus, everolimus) nebo inhibitorem neprilysinu, mohou mít zvýšené riziko angioedému (viz OPATŘENÍ ).
Střevní angioedém
pacientů léčených ACE inhibitory byl hlášen střevní angioedém. U těchto pacientů se objevily bolesti břicha (s nevolností nebo zvracením nebo bez nich); v některých případech nebyl v anamnéze obličejový angioedém a hladiny C-1 esterázy byly normální. Angioedém byl diagnostikován procedurami včetně CT břicha nebo ultrazvuku nebo při operaci a symptomy vymizely po vysazení ACE inhibitoru. Střevní angioedém by měl být zahrnut do diferenciální diagnózy pacientů užívajících ACE inhibitory s bolestí břicha.
Pacienti s anamnézou angioedému nesouvisejícího s léčbou ACE inhibitory mohou mít zvýšené riziko angioedému při léčbě ACE inhibitorem (viz také INDIKACE A POUŽITÍ a KONTRAINDIKACE ).
Anafylaktoidní reakce během desenzibilizace
dvou pacientů, kteří podstupovali desenzibilizační léčbu jedem blanokřídlých, zatímco dostávali ACE inhibitory, se udržel život ohrožující anafylaktoidní reakce. U stejných pacientů bylo těmto reakcím zabráněno, když byly ACE inhibitory dočasně vysazeny, ale znovu se objevily po neúmyslném opětovném podání.
Anafylaktoidní reakce během expozice membrány
Anafylaktoidní reakce byly hlášeny u pacientů dialyzovaných pomocí vysokoprůtokových membrán a léčených současně ACE inhibitorem. Anafylaktoidní reakce byly také hlášeny u pacientů podstupujících aferézu lipoproteinů s nízkou hustotou s absorpcí dextransulfátu.
Hypotenze
Nadměrná hypotenze je vzácná u pacientů s nekomplikovanou hypertenzí léčených samotným přípravkem VASOTEC 5 mg. U pacientů se srdečním selháním, kterým byl podáván VASOTEC, dochází běžně k určitému snížení krevního tlaku, zejména po první dávce, ale přerušení léčby pro pokračující symptomatickou hypotenzi obvykle není nutné, pokud jsou dodržovány pokyny pro dávkování; při zahájení léčby je třeba postupovat opatrně (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). Mezi pacienty s rizikem nadměrné hypotenze, někdy spojené s oligurií a/nebo progresivní azotemií a vzácně s akutním selháním ledvin a/nebo úmrtím, patří pacienti s následujícími stavy nebo charakteristikami: srdeční selhání, hyponatremie, léčba vysokými dávkami diuretik, nedávná intenzivní diuréza nebo zvýšení dávky diuretika, renální dialýza nebo závažná deplece objemu a/nebo solí jakékoli etiologie. U pacientů s rizikem nadměrné hypotenze, kteří jsou schopni takové úpravy tolerovat, může být vhodné před zahájením léčby přípravkem VASOTEC 10 mg diuretikum vyloučit (s výjimkou pacientů se srdečním selháním), snížit dávku diuretika nebo opatrně zvýšit příjem soli (viz DROGOVÉ INTERAKCE a NEŽÁDOUCÍ REAKCE ). U pacientů s rizikem nadměrné hypotenze by měla být léčba zahájena pod velmi pečlivým lékařským dohledem a tito pacienti by měli být pečlivě sledováni po dobu prvních dvou týdnů léčby a kdykoli se zvýší dávka enalaprilu a/nebo diuretika. Podobné úvahy se mohou vztahovat na pacienty s ischemickým onemocněním srdce nebo cerebrovaskulárním onemocněním, u kterých by nadměrný pokles krevního tlaku mohl vést k infarktu myokardu nebo cerebrovaskulární příhodě.
Pokud se objeví nadměrná hypotenze, pacient by měl být uložen do polohy na zádech a v případě potřeby by měl dostat intravenózní infuzi fyziologického roztoku. Přechodná hypotenzní odpověď není kontraindikací pro další dávky přípravku VASOTEC 2,5 mg, které lze obvykle podat bez potíží, jakmile se krevní tlak stabilizuje. Pokud se rozvine symptomatická hypotenze, může být nutné snížit dávku nebo vysadit VASOTEC nebo souběžně podávaná diuretika.
Neutropenie/agranulocytóza
jiného inhibitoru angiotenzin konvertujícího enzymu, kaptoprilu, bylo prokázáno, že způsobuje agranulocytózu a útlum kostní dřeně, vzácně u nekomplikovaných pacientů, ale častěji u pacientů s poruchou funkce ledvin, zvláště pokud mají také kolagenní vaskulární onemocnění. Dostupné údaje z klinických studií enalaprilu nejsou dostatečné k prokázání, že enalapril nezpůsobuje agranulocytózu v podobné míře. Marketingové zkušenosti odhalily případy neutropenie nebo agranulocytózy, u kterých nelze vyloučit kauzální vztah k enalaprilu. Je třeba zvážit pravidelné sledování počtu bílých krvinek u pacientů s kolagenovým vaskulárním onemocněním a onemocněním ledvin.
Jaterní selhání
Vzácně byly ACE inhibitory spojovány se syndromem, který začíná cholestatickou žloutenkou a progreduje do fulminantní jaterní nekrózy a (někdy) smrti. Mechanismus tohoto syndromu není znám. Pacienti užívající ACE inhibitory, u kterých se rozvine žloutenka nebo výrazné zvýšení jaterních enzymů, by měli vysadit ACE inhibitor a podstoupit vhodné lékařské sledování.
Fetální toxicita
Užívání léků, které působí na renin-angiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Při zjištění těhotenství přerušte co nejdříve VASOTEC 10 mg. Tyto nežádoucí účinky jsou obvykle spojeny s užíváním těchto léků ve druhém a třetím trimestru těhotenství. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenzivum v prvním trimestru nerozlišuje léky ovlivňující renin-angiotensinový systém od jiných antihypertenziv. Vhodná léčba hypertenze matky během těhotenství je důležitá pro optimalizaci výsledků pro matku i plod.
neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativa k léčbě léky ovlivňujícími reninangiotensinový systém, informujte matku o potenciálním riziku pro plod. Proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. Pokud je pozorován oligohydramnion, přerušte podávání VASOTECu, pokud to není považováno za záchranu života matky. V závislosti na týdnu těhotenství může být vhodné provést fetální testování. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění. Pečlivě sledujte kojence s anamnézou expozice VASOTEC in utero kvůli hypotenzi, oligurii a hyperkalémii (viz OPATŘENÍ , Pediatrické použití ).
Ve studiích u březích potkanů a králíků nebyly pozorovány žádné teratogenní účinky enalaprilu. Na základě tělesného povrchu byly použité dávky 57krát a 12krát vyšší než maximální doporučená denní dávka pro člověka (MRHDD).
OPATŘENÍ
Všeobecné
Aortální stenóza/hypertrofická kardiomyopatie
Jako u všech vazodilatancií by měl být enalapril podáván s opatrností pacientům s obstrukcí ve výtokovém traktu levé komory.
Porucha funkce ledvin
V důsledku inhibice systému renin-angiotenzin-aldosteron lze u citlivých jedinců předpokládat změny funkce ledvin. U pacientů se závažným srdečním selháním, jejichž funkce ledvin může záviset na aktivitě systému renin-angiotenzin-aldosteron, může být léčba inhibitory angiotenzin konvertujícího enzymu, včetně přípravku VASOTEC, spojena s oligurií a/nebo progresivní azotemií a vzácně s akutním selháním ledvin a /nebo smrt (viz DROGOVÉ INTERAKCE ).
V klinických studiích u hypertoniků s jednostrannou nebo oboustrannou stenózou renální arterie bylo u 20 procent pacientů pozorováno zvýšení dusíku močoviny v krvi a sérového kreatininu. Tato zvýšení byla téměř vždy reverzibilní po přerušení léčby enalaprilem a/nebo diuretiky. U těchto pacientů by měla být během prvních několika týdnů léčby sledována funkce ledvin.
některých pacientů s hypertenzí nebo srdečním selháním bez zjevného preexistujícího renálního vaskulárního onemocnění došlo ke zvýšení urey v krvi a sérového kreatininu, obvykle mírnému a přechodnému, zvláště když byl VASOTEC podáván současně s diuretikem. To se pravděpodobněji vyskytuje u pacientů s již existující poruchou funkce ledvin. Může být nutné snížit dávku a/nebo vysadit diuretikum a/nebo VASOTEC 5 mg.
Hodnocení pacientů s hypertenzí nebo srdečním selháním by mělo vždy zahrnovat posouzení funkce ledvin (vidět DÁVKOVÁNÍ A PODÁVÁNÍ ).
Hyperkalémie
Zvýšená hladina draslíku v séru (více než 5,7 mEq/l) byla v klinických studiích pozorována u přibližně jednoho procenta pacientů s hypertenzí. Ve většině případů se jednalo o izolované hodnoty, které se upravily i přes pokračující terapii. Hyperkalémie byla příčinou přerušení léčby u 0,28 procenta hypertoniků. V klinických studiích u srdečního selhání byla hyperkalémie pozorována u 3,8 procent pacientů, ale nebyla důvodem k přerušení léčby.
Rizikové faktory pro rozvoj hyperkalémie zahrnují renální insuficienci, diabetes mellitus a současné užívání draslík šetřících diuretik, doplňků draslíku a/nebo náhražek soli obsahujících draslík, které by měly být používány s opatrností, pokud vůbec, s přípravkem VASOTEC (viz DROGOVÉ INTERAKCE ).
Kašel
Pravděpodobně v důsledku inhibice degradace endogenního bradykininu byl u všech ACE inhibitorů hlášen přetrvávající neproduktivní kašel, který vždy odezněl po přerušení léčby. Kašel vyvolaný ACE inhibitory by měl být zvažován v diferenciální diagnostice kašle.
Chirurgie/Anestezie
U pacientů podstupujících velký chirurgický výkon nebo během anestezie látkami, které vyvolávají hypotenzi, může enalapril blokovat tvorbu angiotenzinu II sekundárně po kompenzačním uvolňování reninu. Pokud se objeví hypotenze a je považována za důsledek tohoto mechanismu, lze ji upravit objemovou expanzí.
Karcinogeneze, mutageneze, zhoršení plodnosti
Nebylo prokázáno tumorigenní účinek, když byl enalapril podáván po dobu 106 týdnů samcům a samicím potkanů v dávkách až 90 mg/kg/den nebo po dobu 94 týdnů samcům a samicím myší v dávkách až 90 a 180 mg/kg/ den, resp. Tyto dávky jsou 26násobkem (u potkanů a myších samic) a 13násobkem (u myších samců) maximální doporučené denní dávky pro člověka (MRHDD) ve srovnání na základě plochy povrchu těla.
Ani enalapril maleát ani aktivní dikyselina nebyly mutagenní v Amesově mikrobiálním mutagenním testu s metabolickou aktivací nebo bez ní. Enalapril byl také negativní v následujících studiích genotoxicity: opakovaný test, test reverzních mutací s E. coli, výměna sesterských chromatid s kultivovanými savčími buňkami a mikronukleární test na myších, stejně jako v cytogenní studii in vivo s použitím myší kostní dřeně .
Nebyly pozorovány žádné nepříznivé účinky na reprodukční schopnost samců a samic potkanů léčených až 90 mg/kg/den enalaprilu (26násobek MRHDD ve srovnání na základě plochy povrchu těla).
Těhotenství
Kojící matky
Enalapril a enalapril byly zjištěny v lidském mateřském mléce. Vzhledem k potenciálu závažných nežádoucích účinků enalaprilu u kojených dětí je třeba rozhodnout, zda přerušit kojení nebo přerušit léčbu přípravkem VASOTEC 2,5 mg, přičemž je třeba vzít v úvahu důležitost léku pro matku.
Pediatrické použití
Novorozenci s historií in utero expozice VASOTEC
Pokud se objeví oligurie nebo hypotenze, zaměřte pozornost na podporu krevního tlaku a renální perfuze. Výměnné transfuze nebo dialýza mohou být nutné jako prostředek ke zvrácení hypotenze a/nebo náhradě poruchy funkce ledvin. Enalapril, který prochází placentou, byl odstraněn z novorozeneckého oběhu peritoneální dialýzou s určitým klinickým přínosem a teoreticky může být odstraněn výměnnou transfuzí, ačkoli s posledně jmenovaným postupem nejsou žádné zkušenosti.
Antihypertenzní účinky přípravku VASOTEC byly prokázány u hypertenzních pediatrických pacientů ve věku od 1 měsíce do 16 let. Použití přípravku VASOTEC 5 mg u těchto věkových skupin je podpořeno důkazy z adekvátních a dobře kontrolovaných studií přípravku VASOTEC 2,5 mg u pediatrických a dospělých pacientů a také publikovanou literaturou u dětských pacientů (viz KLINICKÁ FARMAKOLOGIE , Klinická farmakologie u dětských pacientů a DÁVKOVÁNÍ A PODÁVÁNÍ ).
VASOTEC se nedoporučuje u novorozenců a dětských pacientů s rychlostí glomerulární filtrace
PŘEDÁVKOVAT
předávkování u lidí jsou k dispozici omezené údaje.
Jednotlivé perorální dávky enalaprilu vyšší než 1 000 mg/kg a ≥ 1 775 mg/kg byly spojeny s letalitou u myší a potkanů.
Nejpravděpodobnějším projevem předávkování by byla hypotenze, jejíž obvyklou léčbou by byla intravenózní infuze normálního fyziologického roztoku.
Enalaprilát může být odstraněn z celkového oběhu hemodialýzou a z novorozeneckého oběhu byl odstraněn peritoneální dialýzou (viz VAROVÁNÍ , Anafylaktoidní reakce během expozice membrány ).
KONTRAINDIKACE
VASOTEC 2,5 mg je kontraindikován u pacientů s přecitlivělostí na tento přípravek a u pacientů s anamnézou angioedému souvisejícího s předchozí léčbou inhibitorem angiotenzin konvertujícího enzymu a u pacientů s hereditárním nebo idiopatickým angioedémem.
Nepodávejte aliskiren současně s přípravkem VASOTEC pacientům s diabetem (viz DROGOVÉ INTERAKCE ).
VASOTEC 10 mg je kontraindikován v kombinaci s inhibitorem neprilysinu (např. sacubitril). Nepodávejte VASOTEC do 36 hodin po přechodu na sakubitril/valsartan, inhibitor neprilysinu nebo z něj (viz VAROVÁNÍ ).
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Enalapril po hydrolýze na enalapril inhibuje angiotensin-konvertující enzym (ACE) u lidí a zvířat. ACE je peptidyldipeptidáza, která katalyzuje přeměnu angiotensinu I na vazokonstrikční látku, angiotensin II. Angiotensin II také stimuluje sekreci aldosteronu kůrou nadledvin. Zdá se, že příznivé účinky enalaprilu při hypertenzi a srdečním selhání vyplývají primárně ze suprese systému renin-angiotenzin-aldosteron. Inhibice ACE vede ke snížení plazmatického angiotensinu II, což vede ke snížení vazopresorické aktivity a ke snížení sekrece aldosteronu. Ačkoli je tento pokles malý, vede k malému zvýšení sérového draslíku. U pacientů s hypertenzí léčených samotným přípravkem VASOTEC po dobu až 48 týdnů bylo pozorováno průměrné zvýšení sérového draslíku přibližně o 0,2 mEq/l. U pacientů léčených přípravkem VASOTEC 5 mg a thiazidovým diuretikem nedošlo v podstatě k žádné změně sérového draslíku (viz OPATŘENÍ ). Odstranění negativní zpětné vazby angiotenzinu II na sekreci reninu vede ke zvýšení aktivity plazmatického reninu.
ACE je identický s kininázou, enzymem, který degraduje bradykinin. Zda zvýšené hladiny bradykininu, silného vazodepresorového peptidu, hrají roli v terapeutických účincích VASOTEC, je třeba ještě objasnit.
Zatímco se předpokládá, že mechanismem, kterým VASOTEC 5 mg snižuje krevní tlak, je primárně suprese systému renin-angiotenzin-aldosteron, VASOTEC 10 mg je antihypertenzní i u pacientů s hypertenzí s nízkou hladinou reninu. Přestože byl VASOTEC antihypertenzní u všech sledovaných ras, černošští hypertonici (obvykle hypertenzní populace s nízkým obsahem reninu) měli menší průměrnou odpověď na monoterapii enalaprilem než pacienti jiné rasy.
Farmakokinetika a metabolismus
Po perorálním podání přípravku VASOTEC se maximální sérové koncentrace enalaprilu objeví přibližně do jedné hodiny. Na základě obnovy moči je rozsah absorpce enalaprilu přibližně 60 procent. Absorpce enalaprilu není ovlivněna přítomností potravy v gastrointestinálním traktu. Po absorpci je enalapril hydrolyzován na enalapril, což je účinnější inhibitor angiotenzin konvertujícího enzymu než enalapril; enalaprilát se při perorálním podání špatně vstřebává. Maximální sérové koncentrace enalaprilátu se objevují tři až čtyři hodiny po perorální dávce enalapril maleátu. Vylučování VASOTECu je primárně ledvinové. Přibližně 94 procent dávky se objeví v moči a stolici jako enalaprilát nebo enalapril. Hlavními složkami v moči jsou enalaprilát, který tvoří asi 40 procent dávky, a intaktní enalapril. Neexistují žádné důkazy o metabolitech enalaprilu, kromě enalaprilátu.
Profil sérové koncentrace enalaprilátu vykazuje prodlouženou terminální fázi, která zjevně představuje malý zlomek podané dávky, která se váže na ACE. Vázané množství se s dávkou nezvyšuje, což ukazuje na saturovatelné místo vazby. Efektivní poločas akumulace enalaprilátu po opakovaných dávkách enalapril maleátu je 11 hodin. Dispozice enalaprilu a enalaprilátu u pacientů s renální insuficiencí je podobná jako u pacientů s normální funkcí ledvin, dokud rychlost glomerulární filtrace není 30 ml/min nebo méně. Při rychlosti glomerulární filtrace ≤ 30 ml/min se maximální a minimální hladiny enalaprilátu zvyšují, doba do dosažení maximální koncentrace se zvyšuje a doba do ustáleného stavu může být zpožděna. Účinný poločas enalaprilátu po opakovaných dávkách enalapril-maleinátu je při této úrovni renální insuficience prodloužen (viz DÁVKOVÁNÍ A PODÁVÁNÍ ). Enalaprilát je dialyzovatelný rychlostí 62 ml/min.
Studie na psech ukazují, že enalapril prochází hematoencefalickou bariérou špatně, pokud vůbec; enalaprilát nevstupuje do mozku. Vícenásobné dávky enalapril maleátu u potkanů nevedou k akumulaci v žádných tkáních. Mléko kojících potkanů obsahuje po podání 14C-enalapril maleátu radioaktivitu. Bylo zjištěno, že radioaktivita prochází placentou po podání značeného léku březím křečkům.
Farmakodynamika a klinické účinky
Hypertenze
Podávání přípravku VASOTEC pacientům se závažností hypertenze od mírné po závažnou vede ke snížení krevního tlaku vleže i vestoje, obvykle bez ortostatické složky. Symptomatická posturální hypotenze je proto vzácná, i když ji lze očekávat u pacientů s deplecí objemu (viz VAROVÁNÍ ).
většiny sledovaných pacientů byl po perorálním podání jedné dávky enalaprilu pozorován nástup antihypertenzní aktivity za jednu hodinu s maximálním snížením krevního tlaku dosaženým za čtyři až šest hodin.
Při doporučených dávkách byly antihypertenzní účinky zachovány po dobu nejméně 24 hodin. U některých pacientů mohou účinky slábnout ke konci dávkovacího intervalu (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
U některých pacientů může dosažení optimálního snížení krevního tlaku vyžadovat několik týdnů léčby.
Antihypertenzní účinky přípravku VASOTEC přetrvávaly během dlouhodobé léčby. Náhlé vysazení VASOTEC 10 mg nebylo spojeno s rychlým zvýšením krevního tlaku.
hemodynamických studiích u pacientů s esenciální hypertenzí bylo snížení krevního tlaku doprovázeno snížením periferní arteriální rezistence se zvýšením srdečního výdeje a malou nebo žádnou změnou srdeční frekvence. Po podání přípravku VASOTEC dochází ke zvýšení průtoku krve ledvinami; glomerulární filtrace se obvykle nemění. Zdá se, že účinky jsou podobné u pacientů s renovaskulární hypertenzí.
Při současném podávání s diuretiky thiazidového typu jsou účinky VASOTEC 5 mg na snížení krevního tlaku přibližně aditivní.
V klinické farmakologické studii byly pacientům s hypertenzí, kterým byl podáván VASOTEC, podávány indometacin nebo sulindac. V této studii nebylo prokázáno oslabení antihypertenzního účinku přípravku VASOTEC (viz DROGOVÉ INTERAKCE ).
Srdeční selhání
Ve studiích u pacientů léčených digitalisem a diuretiky vedla léčba enalaprilem ke snížení systémové vaskulární rezistence, krevního tlaku, tlaku v zaklínění plicních kapilár a velikosti srdce a ke zvýšení srdečního výdeje a tolerance zátěže. Srdeční frekvence se nezměnila nebo se mírně snížila a průměrná ejekční frakce se nezměnila nebo se zvýšila. Byl příznivý účinek na závažnost srdečního selhání měřenou klasifikací New York Heart Association (NYHA) a na příznaky dušnosti a únavy. Hemodynamické účinky byly pozorovány po první dávce a zdálo se, že přetrvávají v nekontrolovaných studiích trvajících až čtyři měsíce. Účinky na toleranci zátěže, velikost srdce a závažnost a příznaky srdečního selhání byly pozorovány v placebem kontrolovaných studiích trvajících od osmi týdnů do více než jednoho roku.
Srdeční selhání, zkoušky úmrtnosti
multicentrické, placebem kontrolované klinické studii bylo 2 569 pacientů se všemi stupni symptomatického srdečního selhání a ejekční frakcí ≤ 35 procent randomizováno do skupiny s placebem nebo enalaprilem a sledováno po dobu až 55 měsíců (SOLVD-Léčba). Užívání enalaprilu bylo spojeno s 11procentním snížením mortality ze všech příčin a 30procentním snížením hospitalizací pro srdeční selhání. Mezi onemocnění, která vylučovala pacienty ze zařazení do studie, patřila těžká stabilní angina pectoris (>2 ataky/den), hemodynamicky významná obstrukce chlopňových nebo výtokových cest, selhání ledvin (kreatinin >2,5 mg/dl), cerebrovaskulární onemocnění (např. významné onemocnění karotid) , pokročilé plicní onemocnění, malignity, aktivní myokarditida a konstriktivní perikarditida. Nezdá se, že by mortalita spojená s enalaprilem závisela na přítomnosti digitalisu.
Druhá multicentrická studie použila protokol SOLVD pro studium asymptomatických nebo minimálně symptomatických pacientů. Pacienti s prevencí SOLVD, kteří měli ejekční frakci levé komory ≤ 35 % a bez anamnézy symptomatického srdečního selhání, byli randomizováni k placebu (n=2117) nebo enalaprilu (n=2111) a sledováni po dobu až 5 let. Většina pacientů ve studii SOLVD-Prevention měla v anamnéze ischemickou chorobu srdeční. Infarkt myokardu byl přítomen u 80 procent pacientů, současná angina pectoris u 34 procent a anamnéza hypertenze u 37 procent. U této populace nebyl prokázán statisticky významný vliv na mortalitu. Subjekty léčené enalaprilem měly o 32 % méně prvních hospitalizací pro srdeční selhání a o 32 % méně hospitalizací pro celkové srdeční selhání. Ve srovnání s placebem se u pacientů užívajících enalapril vyvinuly příznaky zjevného srdečního selhání o 32 procent méně. Snížily se i hospitalizace z kardiovaskulárních důvodů. Ve skupině léčené enalaprilem došlo z jakékoli příčiny k nevýznamnému snížení počtu hospitalizací (u enalaprilu vs. placeba 1 166 vs. 1 201 prvních hospitalizací, 2 649 vs. 2 840 celkem hospitalizací), ačkoli studie nebyla schopna takové účinek.
Studie SOLVD-Prevention nebyla navržena tak, aby určila, zda by léčba asymptomatických pacientů s nízkou ejekční frakcí byla lepší, pokud jde o prevenci hospitalizace, než bližší sledování a užívání enalaprilu při nejčasnějších známkách srdečního selhání. Nicméně za podmínek sledování ve studii SOLVD-Prevention (každé 4 měsíce na studijní klinice; osobní lékař podle potřeby) nemělo 68 % pacientů na placebu, kteří byli hospitalizováni pro srdeční selhání, žádné předchozí příznaky, které by signalizoval zahájení léčby.
Studie SOLVD-Prevention také nebyla navržena tak, aby prokázala, zda enalapril ovlivňuje progresi základního srdečního onemocnění.
V jiné multicentrické, placebem kontrolované studii (CONSENSUS) omezené na pacienty s městnavým srdečním selháním třídy IV NYHA a radiografickým průkazem kardiomegalie bylo použití enalaprilu spojeno se zlepšeným přežitím. Výsledky jsou uvedeny v následující tabulce.
obou studiích CONSENSUS a SOLVD-Léčba pacienti také obvykle dostávali digitalis, diuretika nebo obojí.
Klinická farmakologie u dětských pacientů
Farmakokinetická studie s opakovanými dávkami byla provedena u 40 hypertenzních dětských pacientů mužského a ženského pohlaví ve věku od 2 měsíců do ≤ 16 let po denním perorálním podávání 0,07 až 0,14 mg/kg enalapril maleátu. V ustáleném stavu byl průměrný účinný poločas pro akumulaci enalaprilátu 14 hodin a průměrná močová izolace celkového enalaprilu a enalaprilátu za 24 hodin byla 68 % podané dávky. Konverze enalaprilu na enalapril se pohybovala v rozmezí 63–76 %. Celkové výsledky této studie ukazují, že farmakokinetika enalaprilu u hypertenzních dětí ve věku od 2 měsíců do ≤ 16 let je konzistentní napříč studovanými věkovými skupinami a je konzistentní s farmakokinetickými historickými údaji u zdravých dospělých.
klinické studii zahrnující 110 hypertenzních pediatrických pacientů ve věku 6 až 16 let dostávali pacienti s tělesnou hmotností
Ve výše uvedených pediatrických studiích byl enalapril maleát podáván ve formě tablet přípravku VASOTEC a těm dětem a kojencům, kteří nebyli schopni polykat tablety nebo kteří vyžadovali nižší dávku, než je dostupná ve formě tablet, byl enalapril podáván ve formě suspenze (viz DÁVKOVÁNÍ A PODÁVÁNÍ , Příprava Suspenze ).
INFORMACE PRO PACIENTA
Angioedém
Angioedém, včetně laryngeálního edému, se může objevit kdykoli během léčby inhibitory angiotenzin konvertujícího enzymu, včetně enalaprilu. Pacienti by měli být poučeni a poučeni, aby okamžitě hlásili jakékoli známky nebo příznaky naznačující angioedém (otoky obličeje, končetin, očí, rtů, jazyka, potíže s polykáním nebo dýcháním) a aby neužívali další lék, dokud se neporadí s předepisujícím lékařem.
Hypotenze
Pacienti by měli být upozorněni, aby hlásili závratě, zejména během prvních několika dnů léčby. Pokud se objeví skutečná synkopa, pacienti by měli být informováni, aby přerušili léčbu, dokud se neporadí s předepisujícím lékařem. Všichni pacienti by měli být upozorněni, že nadměrné pocení a dehydratace mohou vést k nadměrnému poklesu krevního tlaku v důsledku snížení objemu tekutin. Jiné příčiny objemové deplece, jako je zvracení nebo průjem, mohou také vést k poklesu krevního tlaku; pacientům je třeba doporučit, aby se poradili s lékařem.
Hyperkalémie
Pacienty je třeba upozornit, aby nepoužívali náhražky soli obsahující draslík bez porady se svým lékařem.
Neutropenie
Pacienti by měli být informováni, aby neprodleně hlásili jakékoli známky infekce (např. bolest v krku, horečka), které mohou být známkou neutropenie.
Těhotenství
Pacientky ve fertilním věku by měly být informovány o důsledcích expozice VASOTECu během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Pacientky by měly být požádány, aby co nejdříve hlásily těhotenství svým lékařům.
POZNÁMKA: Stejně jako u mnoha jiných léků jsou určité rady pacientům léčeným enalaprilem opodstatněné. Tyto informace mají pomoci při bezpečném a účinném užívání tohoto léku. Nejedná se o odhalení všech možných nepříznivých nebo zamýšlených účinků.
