Minipress 1mg, 2mg Prazosin Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Minipress a jak se používá?
Minipress (prazosin hydrochlorid) je alfa-adrenergní blokátor používaný k léčbě hypertenze (vysokého krevního tlaku).
Jaké jsou vedlejší účinky Minipressu 2 mg?
Mezi časté nežádoucí účinky přípravku Minipress 1 mg patří:
- bolest hlavy,
- ospalost,
- únava,
- slabost,
- rozmazané vidění,
- nevolnost,
- zvracení,
- průjem, popř
- zácpa, když se vaše tělo přizpůsobuje medikaci
Mezi další nežádoucí účinky Minipress 2 mg patří:
- točení hlavy nebo závratě při postavení, zvláště po první dávce a krátce po užití dávky léku během prvního týdne léčby.
Informujte svého lékaře, pokud zaznamenáte závažné nežádoucí účinky přípravku Minipress 1 mg včetně rychlého nebo bušení srdce nebo chvění na hrudi, pocit, že byste mohli omdlít, potíže s dýcháním, otoky rukou nebo nohou nebo erekci, která je bolestivá nebo trvá 4 hodiny. nebo déle.
POPIS
MINIPRESS® (prazosin hydrochlorid), derivát chinazolinu, je první z nové chemické třídy antihypertenziv. Je to hydrochloridová sůl 1-(4-amino-6,7-dimethoxy-2-chinazolinyl)-4-(2-furoyl)piperazinu a její strukturní vzorec je:
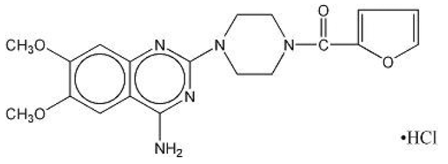
Molekulární vzorec C19H21N5O4•HCl
Je to bílá krystalická látka, mírně rozpustná ve vodě a izotonickém fyziologickém roztoku a má molekulovou hmotnost 419,87. Každá 1 mg tobolka MINIPRESS pro perorální podání obsahuje lék ekvivalentní 1 mg volné báze.
Inertní složky ve formulacích jsou: tvrdé želatinové kapsle (které mohou obsahovat modrou 1, červenou 3, červenou 28, červenou 40 a další inertní složky); stearát hořečnatý; laurylsulfát sodný; škrob; sacharóza.
INDIKACE
MINIPRESS 1 mg je indikován k léčbě hypertenze, ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko fatálních i nefatálních kardiovaskulárních příhod, především mozkových mrtvic a infarktů myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd, včetně tohoto léčiva.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než jeden lék. Konkrétní rady ohledně cílů a managementu naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak.
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu a lze dojít k závěru, že se jedná o snížení krevního tlaku a ne o některé další farmakologické vlastnosti. léky, které jsou z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika cévní mozkové příhody, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je v populacích podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů by se dalo očekávat těžit z agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie.
MINIPRESS lze užívat samostatně nebo v kombinaci s jinými antihypertenzivy, jako jsou diuretika nebo beta-adrenergní blokátory.
DÁVKOVÁNÍ A PODÁVÁNÍ
Dávka MINIPRESS 1 mg by měla být upravena podle individuální odpovědi krevního tlaku pacienta. Následuje průvodce jeho administrací:
Počáteční dávka
1 mg dvakrát nebo třikrát denně (viz VAROVÁNÍ .)
Udržovací dávka
Dávkování lze pomalu zvyšovat až na celkovou denní dávku 20 mg podávanou v rozdělených dávkách. Nejčastěji používané terapeutické dávky se pohybovaly od 6 mg do 15 mg denně podávané v rozdělených dávkách. Dávky vyšší než 20 mg obvykle nezvyšují účinnost, avšak několik pacientů může mít prospěch z dalšího zvýšení až na denní dávku 40 mg podávanou v rozdělených dávkách. Po počáteční titraci lze u některých pacientů adekvátně udržovat dávkovací režim dvakrát denně.
Použití s jinými léky
Při přidání diuretika nebo jiného antihypertenziva by měla být dávka přípravku MINIPRESS 1 mg snížena na 1 mg nebo 2 mg třikrát denně a poté by měla být provedena retitrace.
Současné podávání MINIPRESS 1 mg s inhibitorem PDE-5 může mít za následek aditivní účinky na snížení krevního tlaku a symptomatickou hypotenzi; proto by měla být léčba inhibitorem PDE-5 u pacientů užívajících MINIPRESS zahájena nejnižší dávkou.
JAK DODÁVÁNO
Distribuce: Pfizer Labs, Divsion of Pfizer Inc., NY, NY 10017. Revize: únor 2015
VEDLEJŠÍ EFEKTY
Klinické studie byly provedeny na více než 900 pacientech. Během těchto studií a následných marketingových zkušeností jsou nejčastější reakce spojené s léčbou MINIPRESS: závratě 10,3 %, bolest hlavy 7,8 %, ospalost 7,6 %, nedostatek energie 6,9 %, slabost 6,5 %, bušení srdce 5,3 % a nauzea 4,9 %. Ve většině případů vedlejší účinky vymizely s pokračující léčbou nebo byly tolerovány bez snížení dávky léku.
Méně časté nežádoucí účinky, které se vyskytují u 1–4 % pacientů, jsou:
Gastrointestinální: zvracení, průjem, zácpa.
Kardiovaskulární: edém, ortostatická hypotenze, dušnost, synkopa.
Centrální nervový systém: vertigo, deprese, nervozita.
Dermatologické: vyrážka.
Genitourinární: frekvence močení.
EENT: rozmazané vidění, zarudlé skléry, epistaxe, sucho v ústech, ucpaný nos.
Kromě toho méně než 1 % pacientů uvedlo následující (v některých případech nebyly stanoveny přesné příčinné souvislosti):
Gastrointestinální: břišní diskomfort a/nebo bolest, abnormality jaterních funkcí, pankreatitida.
Kardiovaskulární: tachykardie.
Centrální nervový systém: parestézie, halucinace.
Dermatologické: pruritus, alopecie, lichen planus.
Genitourinární: inkontinence, impotence, priapismus.
EENT: tinnitus.
Jiný: pocení, horečka, pozitivní titr ANA, artralgie.
Byly hlášeny ojedinělé zprávy o pigmentové skvrnitosti a serózní retinopatii a několik zpráv o rozvoji nebo vymizení katarakty. V těchto případech nebyla přesná příčinná souvislost stanovena, protože základní pozorování byla často neadekvátní.
Ve specifičtějších studiích se štěrbinovou lampou a funduskopických studiích, které zahrnovaly adekvátní základní vyšetření, nebyly hlášeny žádné abnormální oftalmologické nálezy související s lékem.
Existují literární zprávy spojující terapii MINIPRESS 1 mg se zhoršením již existující narkolepsie. Příčinná souvislost je v těchto případech nejistá.
Po uvedení přípravku na trh byly hlášeny následující nežádoucí účinky:
Autonomní nervový systém: proplachování.

Tělo jako celek: alergická reakce, astenie, malátnost, bolest.
Kardiovaskulární, obecné: angina pectoris, hypotenze.
Endokrinní: gynekomastie.
Srdeční frekvence/rytmus: bradykardie.
psychiatrické: nespavost.
Kůže/přílohy: kopřivka.
Cévní (extrakardiální): vaskulitida.
Vidění: bolest očí.
Speciální smysly: Během operace šedého zákalu byla v souvislosti s léčbou alfa-1 blokátory hlášena varianta syndromu malé zornice známé jako syndrom intraoperační plovoucí duhovky (IFIS) (viz OPATŘENÍ ).
DROGOVÉ INTERAKCE
MINIPRESS 2 mg byl podáván bez jakýchkoli nežádoucích lékových interakcí s dosud omezenými klinickými zkušenostmi s následujícími látkami: (1) srdeční glykosidy-digitalis a digoxin; (2) hypoglykemika - inzulín, chlorpropamid, fenformin, tolazamid a tolbutamid; (3) trankvilizéry a sedativa - chlordiazepoxid, diazepam a fenobarbital; (4) antidna-allopurinol, kolchicin a probenecid; (5) antiarytmika-prokainamid, propranolol (viz VAROVÁNÍ nicméně) a chinidin; a (6) analgetika, antipyretika a protizánětlivá činidla - propoxyfen, aspirin, indometacin a fenylbutazon.
Bylo prokázáno, že přidání diuretika nebo jiného antihypertenziva k přípravku MINIPRESS 2 mg způsobuje aditivní hypotenzní účinek. Tento účinek lze minimalizovat snížením dávky MINIPRESS na 1 až 2 mg třikrát denně, opatrným podáváním dalších antihypertenziv a poté opětovnou titrací přípravku MINIPRESS na základě klinické odpovědi. Současné podávání přípravku MINIPRESS s inhibitorem fosfodiesterázy-5 (PDE-5) může vést k aditivnímu snížení krevního tlaku a symptomatické hypotenzi (viz DÁVKOVÁNÍ A PODÁVÁNÍ ).
Interakce drog/laboratorních testů
Ve studii na pěti pacientech, kterým bylo podáváno 12 až 24 mg prazosinu denně po dobu 10 až 14 dnů, došlo k průměrnému zvýšení metabolitu norepinefrinu v moči o 42 % a průměrnému zvýšení VMA v moči o 17 %. Proto se u pacientů léčených prazosinem mohou objevit falešně pozitivní výsledky ve screeningových testech na feochromocytom. Pokud je zjištěna zvýšená VMA, prazosin by měl být vysazen a pacient znovu testován po měsíci.
Laboratorní testy
V klinických studiích, ve kterých byly sledovány lipidové profily, nebyly obecně zaznamenány žádné nežádoucí změny mezi hladinami lipidů před a po léčbě.
VAROVÁNÍ
Stejně jako všechny alfa-blokátory může MINIPRESS způsobit synkopu s náhlou ztrátou vědomí. Ve většině případů se má za to, že je to způsobeno nadměrným posturálním hypotenzním účinkem, i když občas synkopalepise předcházel záchvat těžké tachykardie se srdeční frekvencí 120-160 tepů za minutu. Syncopalepis ódy se obvykle objevily během 30 až 90 minut od počáteční dávky léku; občas byly hlášeny v souvislosti s rychlým zvýšením dávky nebo zavedením jiného antihypertenziva do režimu u pacienta užívajícího vysoké dávky MINIPRESSu. Incidence synkopalepisových odezev je přibližně 1 % u pacientů, kterým byla podávána počáteční dávka 2 mg nebo vyšší. Klinické studie provedené během výzkumné fáze tohoto léku naznačují, že synkopální epizody lze minimalizovat omezením počáteční dávky léku na 1 mg, následným pomalým zvyšováním dávky a zavedením jakýchkoli dalších antihypertenziv do režimu pacienta. opatrně (viz DÁVKOVÁNÍ A PODÁVÁNÍ). Hypotenze se může vyvinout u pacientů užívajících MINIPRESS, kteří také užívají beta-blokátor, jako je propranolol.
Pokud se objeví synkopa, pacient by měl být uložen do lehu a podle potřeby by měl být léčen podpůrně. Tento nežádoucí účinek sám odezní a ve většině případů se po počátečním období terapie nebo během následné titrace dávky neopakuje.
Pacienti by měli vždy začít užívat 1 mg tobolky přípravku MINIPRESS. 2 a 5 mg tobolky nejsou indikovány k počáteční léčbě.
Častější než ztráta vědomí jsou příznaky často spojené se snížením krevního tlaku, jmenovitě závratě a točení hlavy. Pacient by měl být před těmito možnými nežádoucími účinky upozorněn a měl by mu být doporučeno, jaká opatření by měla učinit, pokud se u nich objeví. Pacient by měl být také upozorněn, aby se vyhnul situacím, kdy by mohlo dojít ke zranění, pokud by se během zahájení léčby přípravkem MINIPRESS 2 mg objevila synkopa.
Priapismus
Po uvedení na trh byly u alfa-1 blokátorů včetně prazosinu hlášeny prodloužené erekce a priapismus. V případě erekce, která přetrvává déle než 4 hodiny, okamžitě vyhledejte lékařskou pomoc. Pokud není priapismus okamžitě léčen, může dojít k poškození tkáně penisu a trvalé ztrátě potence.
OPATŘENÍ
Všeobecné
některých pacientů léčených alfa-1 blokátory byl během operace katarakty pozorován intraoperační syndrom plovoucí duhovky (IFIS). Tato varianta syndromu malé zornice je charakterizována kombinací ochablé duhovky, která se vlní v reakci na intraoperační irigační proudy, progresivní intraoperační miózou navzdory předoperační dilataci standardními mydriatickými léky a potenciálním prolapsem duhovky směrem k fakoemulzifikačním řezům. Oftalmolog pacienta by měl být připraven na možné úpravy chirurgické techniky, jako je použití háčků duhovky, kroužků dilatátoru duhovky nebo viskoelastických látek. Nezdá se, že by ukončení léčby alfa-1 blokátory před operací katarakty mělo přínos.
Karcinogeneze, mutageneze, zhoršení plodnosti
18měsíční studii na potkanech s MINIPRESS 1 mg v dávkách vyšších než 225násobek obvyklé maximální doporučené dávky pro člověka 20 mg denně nebyl prokázán žádný karcinogenní potenciál. MINIPRESS 2 mg nebyl mutagenní ve studiích genetické toxikologie in vivo. Ve studii fertility a obecné reprodukční schopnosti u potkanů, samců i samic, kterým byla podávána dávka 75 mg/kg (225násobek obvyklé maximální doporučené dávky pro člověka), prokázala sníženou plodnost, zatímco ti, kteří byli léčeni dávkou 25 mg/kg (75násobek obvyklé dávky maximální doporučená dávka pro člověka) ne.
chronických studiích (jeden rok nebo déle) přípravku MINIPRESS na potkanech a psech se při dávce 25 mg/kg/den (75násobek obvyklé maximální doporučené dávky pro člověka) vyskytly změny varlat zahrnující atrofii a nekrózu. U potkanů nebo psů nebyly pozorovány žádné změny varlat při dávce 10 mg/kg/den (30násobek obvyklé maximální doporučené dávky pro člověka). S ohledem na změny varlat pozorované u zvířat bylo 105 pacientů na dlouhodobé léčbě MINIPRESS sledováno na vylučování 17-ketosteroidů a nebyly pozorovány žádné změny indikující účinek léku. Navíc 27 mužů užívajících MINIPRESS 1 mg po dobu až 51 měsíců nevykazovalo změny v morfologii spermií, které by naznačovaly účinek léku.
Použití v těhotenství
Kategorie těhotenství C. Bylo prokázáno, že MINIPRESS 1 mg je spojen se snížením velikosti vrhu při narození, ve věku 1, 4 a 21 dnů u potkanů, když byly podávány dávky vyšší než 225násobek obvyklé maximální doporučené dávky pro člověka. Nebyly pozorovány žádné známky vnějších, viscerálních nebo skeletálních abnormalit plodu souvisejících s lékem. U plodů březích králíků a březích opic nebyly pozorovány žádné vnější, viscerální nebo kosterní abnormality související s léčivem při dávkách vyšších než 225krát a 12krát vyšších než je obvyklá maximální doporučená dávka pro člověka.
Použití prazosinu a beta-blokátoru ke kontrole těžké hypertenze u 44 těhotných žen neodhalilo žádné abnormality plodu nebo nežádoucí účinky související s lékem. Terapie prazosinem pokračovala až 14 týdnů.1
Prazosin byl také používán samostatně nebo v kombinaci s jinými hypotenzními přípravky při těžké hypertenzi v těhotenství jinými výzkumníky. Při použití prazosinu nebyly hlášeny žádné fetální nebo neonatální abnormality.2
Neexistují žádné adekvátní a dobře kontrolované studie, které by prokázaly bezpečnost přípravku MINIPRESS u těhotných žen. MINIPRESS by měl být používán během těhotenství pouze tehdy, pokud potenciální přínos ospravedlňuje potenciální riziko pro matku a plod.
Kojící matky
Bylo prokázáno, že MINIPRESS 1 mg se v malých množstvích vylučuje do lidského mléka. Při podávání MINIPRESS 2 mg kojící ženě je třeba opatrnosti.
Použití u dětí
Bezpečnost a účinnost u dětí nebyla stanovena.
REFERENCE
1. Lubbe, WF a Hodge, JV: New Zealand Med J, 94 (691) 169-172, 1981.
2. Davey, DA, a Dommisse, J: SA Med J, 4. října 1980 (551-556).
PŘEDÁVKOVAT
Náhodné požití alespoň 50 mg přípravku MINIPRESS u dvouletého dítěte vedlo k hluboké ospalosti a depresivním reflexům. Nebyl zaznamenán žádný pokles krevního tlaku. Zotavení bylo bezproblémové.
Pokud by předávkování vedlo k hypotenzi, je na prvním místě podpora kardiovaskulárního systému. Obnovení krevního tlaku a normalizace srdeční frekvence lze dosáhnout udržováním pacienta v poloze na zádech. Pokud je toto opatření nedostatečné, měl by být šok nejprve ošetřen pomocí objemových expandérů. V případě potřeby by pak měly být použity vazopresory. Renální funkce by měla být podle potřeby monitorována a podporována. Laboratorní údaje ukazují, že MINIPRESS není dialyzovatelný, protože se váže na proteiny.
KONTRAINDIKACE
MINIPRESS je kontraindikován u pacientů se známou citlivostí na chinazoliny, prazosin nebo kteroukoli inertní složku.
KLINICKÁ FARMAKOLOGIE
Přesný mechanismus hypotenzního účinku prazosinu není znám. Prazosin způsobuje snížení celkové periferní rezistence a původně se předpokládalo, že má přímý relaxační účinek na hladké svalstvo cév. Nedávné studie na zvířatech však naznačují, že vazodilatační účinek prazosinu také souvisí s blokádou postsynaptických alfa-adrenoceptorů. Výsledky experimentů na předních končetinách psů ukazují, že periferní vazodilatační účinek prazosinu je omezen především na úroveň odporových cév (arteriol). Na rozdíl od konvenčních alfa-blokátorů není antihypertenzní účinek prazosinu obvykle doprovázen reflexní tachykardií. Při dlouhodobé léčbě nebyl pozorován rozvoj tolerance.
Hemodynamické studie byly provedeny u člověka po akutním podání jedné dávky a v průběhu dlouhodobé udržovací terapie. Výsledky potvrzují, že terapeutickým účinkem je pokles krevního tlaku bez klinicky významné změny srdečního výdeje, srdeční frekvence, průtoku krve ledvinami a rychlosti glomerulární filtrace. Neexistuje žádný měřitelný negativní chronotropní účinek.
V dosavadních klinických studiích prazosin hydrochlorid nezvýšil aktivitu plazmatického reninu.
U člověka je krevní tlak snížen v poloze na zádech i ve stoje. Tento účinek je nejvýraznější na diastolický krevní tlak.
Po perorálním podání dosahují plazmatické koncentrace u člověka vrcholu přibližně za tři hodiny s plazmatickým poločasem dvě až tři hodiny. Lék se silně váže na plazmatické bílkoviny. Studie biologické dostupnosti prokázaly, že celková absorpce vzhledem k léčivu ve 20% alkoholovém roztoku je 90 %, což vede k maximálním hladinám přibližně 65 % úrovně léčiva v roztoku. Studie na zvířatech ukazují, že prazosin hydrochlorid je rozsáhle metabolizován, primárně demethylací a konjugací, a je vylučován hlavně žlučí a stolicí. Méně rozsáhlé studie na lidech naznačují podobný metabolismus a vylučování u člověka.
V klinických studiích, ve kterých byly sledovány lipidové profily, nebyly obecně zaznamenány žádné nežádoucí změny mezi hladinami lipidů před a po léčbě.
INFORMACE PRO PACIENTA
Po první dávce tohoto léku se mohou objevit závratě nebo ospalost. Během prvních 24 hodin po užití tohoto léku nebo při zvýšení dávky se vyvarujte řízení nebo provádění nebezpečných činností. Mohou se objevit závratě, točení hlavy nebo mdloby, zejména při vstávání z lehu nebo sedu. Pomalé vstávání může pomoci zmírnit problém. Tyto účinky se mohou také objevit, pokud pijete alkohol, dlouho stojíte, cvičíte nebo je horké počasí. Při užívání přípravku MINIPRESS buďte opatrní v množství alkoholu, který pijete. Dbejte také zvýšené opatrnosti při cvičení nebo horkém počasí nebo při dlouhém stání. Máte-li nějaké otázky, obraťte se na svého lékaře.
