Prinivil 2.5mg, 5mg, 10mg Lisinopril Použití, vedlejší účinky a dávkování. Cena v internetové lékárně. Generické léky bez předpisu.
Co je Prinivil 2,5 mg a jak se používá?
Prinivil je lék na předpis používaný k léčbě příznaků vysokého krevního tlaku (hypertenze) po srdečním infarktu nebo srdečním selhání. Prinivil lze užívat samostatně nebo s jinými léky.
- Prinivil patří do třídy léků nazývaných ACE inhibitory.
- Není známo, zda je Prinivil bezpečný a účinný u dětí mladších 6 let.
Jaké jsou možné vedlejší účinky přípravku Prinivil?
Prinivil může způsobit závažné nežádoucí účinky, včetně:
- točení hlavy,
- horečka,
- bolest krku,
- nevolnost,
- slabost,
- štiplavý pocit,
- bolest na hrudi,
- nepravidelný srdeční tep,
- ztráta pohybu,
- malé nebo žádné močení,
- otoky nohou nebo kotníků,
- cítit se unaveně,
- dušnost,
- bolest v horní části žaludku,
- svědění,
- pocit únavy,
- ztráta chuti k jídlu,
- tmavá moč,
- stolice hliněné barvy, a
- zežloutnutí kůže nebo očí (žloutenka)
Pokud máte některý z výše uvedených příznaků, okamžitě vyhledejte lékařskou pomoc.
Mezi nejčastější vedlejší účinky přípravku Prinivil 5 mg patří:
- bolest hlavy,
- závrať,
- kašel a
- bolest na hrudi
Informujte lékaře, pokud máte jakýkoli nežádoucí účinek, který vás obtěžuje nebo který neustupuje.
To nejsou všechny možné vedlejší účinky Prinivilu. Pro více informací se zeptejte svého lékaře nebo lékárníka.
Zavolejte svého lékaře o radu ohledně nežádoucích účinků. Nežádoucí účinky můžete hlásit úřadu FDA na čísle 1-800-FDA-1088.
VAROVÁNÍ
FETÁLNÍ TOXICITA
- Když je zjištěno těhotenství, přerušte přípravek PRINIVIL co nejdříve (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ).
- Léky, které působí přímo na systém renin-angiotenzin, mohou způsobit zranění a smrt vyvíjejícího se plodu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ).
POPIS
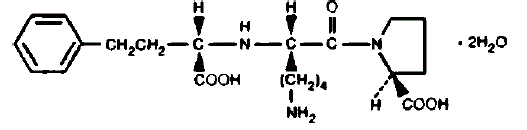
PRINIVIL obsahuje lisinopril, syntetický peptidový derivát, a perorální, dlouhodobě působící inhibitor enzymu konvertujícího angiotenzin. Lisinopril je chemicky popsán jako dihydrát (S)-1-[N2-(1-karboxy-3-fenylpropyl)-Llysyl]-L-prolinu. Jeho empirický vzorec je C21H31N3O5•2H2O a jeho strukturní vzorec je:
Lisinopril je bílý až téměř bílý krystalický prášek s molekulovou hmotností 441,52. Je rozpustný ve vodě a těžce rozpustný v methanolu a prakticky nerozpustný v ethanolu.
PRINIVIL 10 mg se dodává jako 5 mg, 10 mg a 20 mg tablety pro perorální podání. Kromě účinné složky lisinoprilu obsahuje každá tableta následující neaktivní složky: fosforečnan vápenatý, mannitol, stearát hořečnatý a škrob. Tablety 10 mg a 20 mg také obsahují oxid železitý.
INDIKACE
Hypertenze
PRINIVIL je indikován k léčbě hypertenze u dospělých pacientů a dětských pacientů ve věku 6 let a starších ke snížení krevního tlaku. Snížení krevního tlaku snižuje riziko fatálních a nefatálních kardiovaskulárních příhod, především mozkových příhod a infarktů myokardu. Tyto přínosy byly pozorovány v kontrolovaných studiích antihypertenziv ze široké škály farmakologických tříd.
Kontrola vysokého krevního tlaku by měla být součástí komplexního řízení kardiovaskulárních rizik, včetně kontroly lipidů, léčby diabetu, antitrombotické léčby, odvykání kouření, cvičení a omezeného příjmu sodíku. Mnoho pacientů bude k dosažení cílů krevního tlaku potřebovat více než 1 lék. Konkrétní rady ohledně cílů a managementu naleznete v publikovaných pokynech, jako jsou pokyny Společného národního výboru pro prevenci, detekci, hodnocení a léčbu vysokého krevního tlaku (JNC) Národního vzdělávacího programu pro vysoký krevní tlak (National High Blood Pressure Education Program).
randomizovaných kontrolovaných studiích bylo prokázáno, že četná antihypertenziva z různých farmakologických tříd a s různými mechanismy účinku snižují kardiovaskulární morbiditu a mortalitu a lze dojít k závěru, že se jedná o snížení krevního tlaku a ne o některé další farmakologické vlastnosti. léky, které jsou z velké části zodpovědné za tyto výhody. Největším a nejkonzistentnějším kardiovaskulárním přínosem bylo snížení rizika cévní mozkové příhody, ale pravidelně bylo také pozorováno snížení infarktu myokardu a kardiovaskulární mortality.
Zvýšený systolický nebo diastolický tlak způsobuje zvýšené kardiovaskulární riziko a zvýšení absolutního rizika na mmHg je větší při vyšších krevních tlacích, takže i mírné snížení těžké hypertenze může poskytnout podstatný přínos. Snížení relativního rizika snížením krevního tlaku je v populacích podobné s různým absolutním rizikem, takže absolutní přínos je větší u pacientů s vyšším rizikem nezávisle na jejich hypertenzi (například pacienti s diabetem nebo hyperlipidémií), u takových pacientů by se dalo očekávat těžit z agresivnější léčby k cíli nižšího krevního tlaku.
Některá antihypertenziva mají menší účinky na krevní tlak (jako monoterapie) u černošských pacientů a mnoho antihypertenziv má další schválené indikace a účinky (např. na anginu pectoris, srdeční selhání nebo diabetické onemocnění ledvin). Tyto úvahy mohou vést k výběru terapie.
PRINIVIL lze podávat samostatně nebo s jinými antihypertenzivy [viz Klinické studie ].
Srdeční selhání
PRINIVIL je indikován ke snížení známek a příznaků srdečního selhání u pacientů, kteří adekvátně nereagují na diuretika a digitalis (viz Klinické studie ].
Akutní infarkt myokardu
PRINIVIL je indikován ke snížení mortality při léčbě hemodynamicky stabilních pacientů do 24 hodin po akutním infarktu myokardu. Pacienti by měli podle potřeby dostávat standardní doporučenou léčbu, jako jsou trombolytika, aspirin a beta-blokátory [viz Klinické studie ].
DÁVKOVÁNÍ A PODÁVÁNÍ
Hypertenze
Počáteční léčba u dospělých: Doporučená počáteční dávka je 10 mg jednou denně. Upravte dávkování podle reakce krevního tlaku. Obvyklé rozmezí dávek je 20 až 40 mg denně podávaných v jedné denní dávce. Byly použity dávky až 80 mg, ale nezdá se, že by měly větší účinek.
Použití s diuretiky u dospělých
Pokud není krevní tlak kontrolován samotným PRINIVILEM 10 mg, lze přidat nízkou dávku diuretika (např. hydrochlorothiazid 12,5 mg).
Doporučená počáteční dávka u dospělých pacientů s hypertenzí užívajících diuretika je 5 mg jednou denně [viz DROGOVÉ INTERAKCE ].
Pediatričtí pacienti ve věku 6 let a starší s hypertenzí
U pediatrických pacientů s rychlostí glomerulární filtrace >30 ml/min/1,73 m² je doporučená počáteční dávka 0,07 mg/kg jednou denně (až do 5 mg celkem). Dávkování by mělo být upraveno podle odpovědi krevního tlaku až na maximum 0,61 mg/kg (až 40 mg) jednou denně. Dávky nad 0,61 mg/kg (nebo vyšší než 40 mg) nebyly u pediatrických pacientů studovány (viz KLINICKÁ FARMAKOLOGIE ].
PRINIVIL 2,5 mg se nedoporučuje u pediatrických pacientů Použití u konkrétních populací a Klinické studie ].
Srdeční selhání
Doporučená počáteční dávka přípravku PRINIVIL 2,5 mg při použití s diuretiky a (obvykle) digitalisem jako doplňková léčba je 5 mg jednou denně. Doporučená počáteční dávka u těchto pacientů s hyponatrémií (sodík v séru
Může být nutné upravit dávku diuretika, aby se minimalizovala hypovolémie, která může přispívat k hypotenzi [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ]. Výskyt hypotenze po úvodní dávce přípravku PRINIVIL nevylučuje následnou pečlivou titraci dávky léku po účinném zvládnutí hypotenze.
Akutní infarkt myokardu
U hemodynamicky stabilních pacientů do 24 hodin od nástupu příznaků akutního infarktu myokardu podávejte PRINIVIL 5 mg perorálně, poté 5 mg po 24 hodinách, 10 mg po 48 hodinách a poté 10 mg jednou denně. Dávkování by mělo pokračovat po dobu nejméně 6 týdnů.
Zahajte léčbu dávkou 2,5 mg u pacientů s nízkým systolickým krevním tlakem (100-120 mmHg) během prvních 3 dnů po infarktu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Pokud se objeví hypotenze (systolický krevní tlak ≤ 100 mmHg), zvažte dávku 2,5 nebo 5 mg. Pokud se objeví prodloužená hypotenze (systolický krevní tlak
Dávka U pacientů s poruchou ledvin
U pacientů s clearance kreatininu >30 ml/min není nutná žádná úprava dávky přípravku PRINIVIL 2,5 mg. U pacientů s clearance kreatininu 10-30 ml/min snižte počáteční dávku PRINIVILU na polovinu obvyklé doporučené dávky (tj. hypertenze 5 mg; srdeční selhání nebo akutní IM 2,5 mg). U pacientů na hemodialýze nebo clearance kreatininu Použití u konkrétních populací a KLINICKÁ FARMAKOLOGIE ].
Příprava Suspenze
Pro přípravu 200 ml suspenze o koncentraci 1,0 mg/ml přidejte 10 ml čištěné vody USP do polyethylentereftalátové (PET) lahvičky obsahující deset 20mg tablet PRINIVIL 5 mg a protřepávejte po dobu alespoň jedné minuty. Přidejte 30 ml perorálního roztoku citrátu sodného a kyseliny citronové nebo ředidla Cytra-2 a 160 ml Ora-Sweet SF™ ke koncentrátu v PET láhvi a jemně protřepejte několik sekund, aby se přísady rozptýlily. Suspenze by měla být uchovávána při teplotě 25 °C (77 °F) nebo nižší a může být skladována po dobu až čtyř týdnů. Před každým použitím suspenzi protřepejte.
JAK DODÁVÁNO
Dávkové formy A Síly
Tablety PRINIVIL, 5 mg, jsou bílé, oválné, lisované tablety s kódem MSD 19 na jedné straně a půlicí rýhou na druhé straně.
Tablety PRINIVIL, 10 mg, jsou světle žluté, lisované tablety oválného tvaru s kódem MSD 106 na jedné straně a půlicí rýhou na druhé straně.
Tablety PRINIVIL, 20 mg, jsou broskvové, oválné lisované tablety s kódem MSD 207 na jedné straně a půlicí rýhou na druhé straně.
Skladování A Manipulace
PRINIVIL 10 mg se dodává jako oválné lisované tablety s půlicí rýhou na jedné straně.
Úložný prostor
Uchovávejte při kontrolované pokojové teplotě, 15-30°C (59-86°F) a chraňte před vlhkostí.
Pokud je balení produktu rozděleno, dávkujte do těsné nádoby.
Distribuuje: Merck Sharp & Dohme Corp., dceřiná společnost MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Upraveno: listopad 2021
VEDLEJŠÍ EFEKTY
Zkušenosti z klinických studií
Protože klinické studie jsou prováděny za velmi odlišných podmínek, nelze míry nežádoucích reakcí pozorované v klinických studiích léku přímo srovnávat s mírami v klinických studiích jiného léku a nemusí odrážet míry pozorované v praxi.
Hypertenze
Následující nežádoucí účinky (události o 2 % vyšší u PRINIVILU 5 mg než u placeba) byly pozorovány u PRINIVILu 2,5 mg oproti placebu: bolest hlavy (5,7 % oproti 1,9 %), závratě (5,4 % oproti 1,9 %), kašel (3,5 % oproti 1,0 % ).
Srdeční selhání
kontrolovaných studiích u pacientů se srdečním selháním byla léčba přerušena u 8,1 % pacientů léčených přípravkem PRINIVIL 10 mg po dobu 12 týdnů ve srovnání se 7,7 % pacientů léčených placebem po dobu 12 týdnů.
Následující nežádoucí účinky (události o 2 % vyšší u PRINIVILu 2,5 mg než u placeba) byly pozorovány u PRINIVILu oproti placebu: hypotenze (4,4 % oproti 0,6 %), bolest na hrudi (3,4 % oproti 1,3 %).
V procesu ATLAS [viz Klinické studie ] u pacientů se srdečním selháním byla vysazení pro nežádoucí účinky podobná ve skupinách s nízkou a vysokou dávkou. Následující nežádoucí účinky, většinou související s inhibicí ACE, byly hlášeny častěji ve skupině s vysokou dávkou:
Akutní infarkt myokardu
Pacienti ve studii GISSI-3 léčení PRINIVILEM 10 mg měli vyšší výskyt hypotenze (9,0 % vs 3,7 %) a renální dysfunkce (2,4 % vs 1,1 %) ve srovnání s pacienty, kteří PRINIVIL neužívali.
Další klinické nežádoucí účinky vyskytující se u 1 % nebo více pacientů s hypertenzí nebo srdečním selháním léčených přípravkem PRINIVIL 2,5 mg v kontrolovaných klinických studiích a nevyskytující se v jiných částech označení jsou uvedeny níže:
Tělo jako celek: Únava, astenie, ortostatické účinky.
Zažívací: Pankreatitida, zácpa, plynatost, sucho v ústech, průjem.
Hematologické: Vzácné případy útlumu kostní dřeně, hemolytické anémie, leukopenie/neutropenie a trombocytopenie.
Endokrinní: Diabetes mellitus, nepřiměřená sekrece antidiuretického hormonu.
Metabolické: Dna
Kůže: Kopřivka, alopecie, fotosenzitivita, erytém, návaly horka, pocení, kožní pseudolymfom, toxická epidermální nekrolýza, Stevens-Johnsonův syndrom a pruritus.
Speciální smysly: Ztráta zraku, diplopie, rozmazané vidění, tinitus, fotofobie, poruchy chuti, poruchy čichu.
Urogenitální: Impotence
Smíšený: Byl hlášen komplex příznaků, který může zahrnovat pozitivní ANA, zvýšenou sedimentaci erytrocytů, artralgii/artritidu, myalgii, horečku, vaskulitidu, eozinofilii, leukocytózu, parestezii a vertigo. Vyrážka, fotosenzitivita nebo jiné dermatologické projevy se mohou objevit samostatně nebo v kombinaci s těmito příznaky.
Výsledky klinických laboratorních testů
Sérum draslíku
V klinických studiích se hyperkalémie (sérový draslík > 5,7 mEq/l) objevila u 2,2 % a 4,8 % pacientů léčených PRINIVILem s hypertenzí a srdečním selháním (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Kreatinin, dusík močoviny v krvi
Mírné zvýšení dusíku močoviny v krvi a sérového kreatininu, reverzibilní po přerušení léčby, bylo pozorováno asi u 2 % pacientů s hypertenzí léčených samotným PRINIVILEM 5 mg. Zvýšení bylo častější u pacientů užívajících současně diuretika a u pacientů se stenózou renální arterie (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Reverzibilní mírné zvýšení dusíku močoviny v krvi a sérového kreatininu bylo pozorováno u 11,6 % pacientů se srdečním selháním při současné léčbě diuretiky. Tyto abnormality často vymizely, když byla dávka diuretika snížena.
Pacienti s akutním infarktem myokardu ve studii GISSI-3 léčení přípravkem PRINIVIL měli vyšší (2,4 % oproti 1,1 % u placeba) výskyt renální dysfunkce v nemocnici a po 6 týdnech (zvýšení koncentrace kreatininu na více než 3 mg/dl nebo zdvojnásobení nebo vyšší než základní koncentrace sérového kreatininu).
Hemoglobin a hematokrit
Malý pokles hemoglobinu (průměr 0,4 mg/dl) a hematokritu (průměr 1,3 %) se často vyskytoval u pacientů léčených přípravkem PRINIVIL 5 mg, ale u pacientů bez jiné příčiny anémie byl klinicky významný jen zřídka. V klinických studiích přerušilo léčbu kvůli anémii méně než 0,1 % pacientů.
Jaterní enzymy
Vzácně se vyskytlo zvýšení jaterních enzymů a/nebo sérového bilirubinu [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Postmarketingové zkušenosti
Následující nežádoucí účinky byly zjištěny během používání lisinoprilu po schválení, které nejsou uvedeny v jiných částech označení. Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léku. Mezi další reakce patří:
Poruchy metabolismu a výživy
Hyponatremie [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ], případy hypoglykémie u diabetických pacientů užívajících perorální antidiabetika nebo inzulín [viz DROGOVÉ INTERAKCE ]
Nervový Systém A Psychiatrické Poruchy
Změny nálady (včetně symptomů deprese), duševní zmatenost
DROGOVÉ INTERAKCE
Diuretika
Zahájení léčby přípravkem PRINIVIL u pacientů užívajících diuretika může vést k nadměrnému snížení krevního tlaku. Možnost hypotenzních účinků přípravku PRINIVIL lze minimalizovat buď snížením nebo vysazením diuretika nebo zvýšením příjmu soli před zahájením léčby přípravkem PRINIVIL. Pokud to není možné, snižte počáteční dávku přípravku PRINIVIL [viz DÁVKOVÁNÍ A PODÁVÁNÍ a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
PRINIVIL 2,5 mg zmírňuje ztráty draslíku způsobené diuretiky thiazidového typu. Draslík šetřící diuretika (spironolakton, amilorid, triamteren a další) nebo jiné léky, které mohou zvýšit hladinu draslíku v séru, mohou zvýšit riziko hyperkalemie. Proto, pokud je indikováno současné užívání takových přípravků, často monitorujte hladinu draslíku v séru pacienta.
Antidiabetika
Současné podávání přípravku PRINIVIL 10 mg a antidiabetik (inzulín, perorální hypoglykemika) může způsobit zvýšený účinek na snížení hladiny krevního cukru s rizikem hypoglykémie.
Nesteroidní protizánětlivé látky včetně selektivních inhibitorů cyklooxygenázy-2 (inhibitory COX-2)
pacientů, kteří jsou starší, s deplecí objemu (včetně těch, kteří jsou léčeni diuretiky) nebo s oslabenou funkcí ledvin, může současné podávání NSAID, včetně selektivních inhibitorů COX-2, s ACE inhibitory, včetně lisinoprilu, vést ke zhoršení funkce ledvin, včetně možné akutní selhání ledvin. Tyto účinky jsou obvykle reverzibilní. U pacientů léčených lisinoprilem a NSAID pravidelně monitorujte renální funkce.
Antihypertenzní účinek ACE inhibitorů, včetně lisinoprilu, může být zeslaben nesteroidními protizánětlivými léky.
Duální blokáda systému renin-angiotenzin (RAS)
Duální blokáda RAS blokátory receptorů pro angiotenzin, ACE inhibitory nebo přímými inhibitory reninu (jako je aliskiren) je spojena se zvýšeným rizikem hypotenze, synkopy, hyperkalemie a změn renálních funkcí (včetně akutního selhání ledvin) ve srovnání s monoterapií.
Do studie Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) bylo zařazeno 1448 pacientů s diabetem 2. typu, zvýšeným poměrem albuminu a kreatininu v moči a sníženou odhadovanou rychlostí glomerulární filtrace (GFR 30 až 89,9 ml/min). lisinopril nebo placebo na pozadí léčby losartanem a sledovali je po dobu mediánu 2,2 roku. Pacienti užívající kombinaci losartanu a lisinoprilu nezískali žádný další přínos ve srovnání s monoterapií pro kombinovaný cílový ukazatel poklesu GFR, konečného stádia renálního onemocnění nebo úmrtí, ale zaznamenali zvýšený výskyt hyperkalémie a akutního poškození ledvin ve srovnání se skupinou s monoterapií .
Obecně se vyhněte kombinovanému užívání inhibitorů RAS. Monitorujte krevní tlak, renální funkce a elektrolyty u pacientů užívajících PRINIVIL 5 mg a další látky, které ovlivňují RAS.
Nepodávejte aliskiren současně s PRINIVILem pacientům s diabetem. Vyhněte se použití aliskirenu s PRINIVILEM 2,5 mg u pacientů s poruchou funkce ledvin (GFR
Lithium
Toxicita lithia byla hlášena u pacientů užívajících lithium současně s léky, které způsobují eliminaci sodíku, včetně ACE inhibitorů. Toxicita lithia byla obvykle reverzibilní po vysazení lithia a ACE inhibitoru. Při souběžném užívání sledujte hladiny lithia v séru.
Zlato
Nitritoidní reakce (příznaky zahrnují zčervenání obličeje, nauzeu, zvracení a hypotenzi) byly vzácně hlášeny u pacientů léčených injekčním zlatem (aurothiomalát sodný) a souběžnou léčbou inhibitory ACE včetně PRINIVILu.
Inhibitory savčího cíle rapamycinu (mTOR).
Pacienti, kteří současně užívají inhibitory mTOR (např. temsirolimus, sirolimus, everolimus), mohou mít zvýšené riziko angioedému (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Neprilysinové inhibitory
Pacienti užívající současně inhibitor neprilysinu (např. sakubitril) mohou mít zvýšené riziko angioedému (viz KONTRAINDIKACE a VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
VAROVÁNÍ
Zahrnuto jako součást OPATŘENÍ sekce.

OPATŘENÍ
Fetální toxicita
PRINIVIL může při podání těhotné ženě způsobit poškození plodu. Užívání léků, které působí na reninangiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Výsledný oligohydramnion může být spojen s hypoplazií plic plodu a deformacemi skeletu. Potenciální neonatální nežádoucí účinky zahrnují hypoplazii lebky, anurii, hypotenzi, selhání ledvin a smrt. Když je zjištěno těhotenství, přerušte přípravek PRINIVIL co nejdříve [viz Použití u konkrétních populací ].
Angioedém A Anafylaktoidní Reakce
Angioedém
Angioedém hlavy a krku
Angioedém obličeje, končetin, rtů, jazyka, glottis a/nebo hrtanu, včetně některých fatálních reakcí, se vyskytl u pacientů léčených inhibitory angiotenzin konvertujícího enzymu, včetně PRINIVILu, kdykoli během léčby. U pacientů s postižením jazyka, hlasivkové štěrbiny nebo hrtanu je pravděpodobné, že dojde k obstrukci dýchacích cest, zejména u pacientů s anamnézou operace dýchacích cest. PRINIVIL 5 mg by měl být okamžitě vysazen a měla by být zajištěna vhodná léčba a sledování, dokud nedojde k úplnému a trvalému vymizení známek a příznaků angioedému.
Pacienti s anamnézou angioedému nesouvisejícího s léčbou ACE inhibitory mohou mít zvýšené riziko angioedému při užívání ACE inhibitoru (viz KONTRAINDIKACE ]. ACE inhibitory byly spojeny s vyšší mírou angioedému u černochů než u pacientů jiné rasy.
Pacienti, kteří dostávají současně ACE inhibitor a inhibitor mTOR (savčí cíl rapamycinu) (např. temsirolimus, sirolimus, everolimus), mohou mít zvýšené riziko angioedému (viz DROGOVÉ INTERAKCE ].
Pacienti, kteří dostávají současně ACE inhibitor a inhibitor neprilysinu, mohou mít zvýšené riziko angioedému (viz KONTRAINDIKACE a DROGOVÉ INTERAKCE ].
Střevní angioedém
U pacientů léčených ACE inhibitory se vyskytl střevní angioedém. U těchto pacientů se objevily bolesti břicha (s nevolností nebo zvracením nebo bez nich); v některých případech nebyl v anamnéze obličejový angioedém a hladiny C-1 esterázy byly normální. V některých případech byl angioedém diagnostikován procedurami zahrnujícími CT vyšetření břicha nebo ultrazvuk nebo při operaci a symptomy vymizely po vysazení ACE inhibitoru.
Anafylaktoidní reakce
Anafylaktoidní reakce během desenzibilizace
U dvou pacientů, kteří podstupovali desenzibilizační léčbu jedem blanokřídlých, zatímco dostávali ACE inhibitory, se udržel život ohrožující anafylaktoidní reakce.
Anafylaktoidní reakce během dialýzy
Náhlé a potenciálně život ohrožující anafylaktoidní reakce se objevily u některých pacientů dialyzovaných pomocí vysokoprůtokových membrán a léčených současně ACE inhibitorem. U takových pacientů musí být dialýza okamžitě ukončena a musí být zahájena agresivní terapie anafylaktoidních reakcí. V těchto situacích nebyly příznaky zmírněny antihistaminiky. U těchto pacientů je třeba zvážit použití jiného typu dialyzační membrány nebo jiné třídy antihypertenziv. Anafylaktoidní reakce byly také hlášeny u pacientů podstupujících aferézu lipoproteinů s nízkou hustotou s absorpcí dextransulfátu.
Porucha funkce ledvin
pacientů léčených přípravkem PRINIVIL pravidelně monitorujte renální funkce. Změny renálních funkcí včetně akutního renálního selhání mohou být způsobeny léky, které inhibují renin-angiotensinový systém. Pacienti, jejichž funkce ledvin může částečně záviset na aktivitě systému renin-angiotenzin (např. pacienti se stenózou renální arterie, chronickým onemocněním ledvin, těžkým městnavým srdečním selháním, po infarktu myokardu nebo objemovou deplecí), mohou být zvláště ohroženi rozvojem akutní renální selhání na PRINIVIL. Zvažte pozastavení nebo přerušení léčby u pacientů, u kterých dojde ke klinicky významnému snížení renálních funkcí na PRINIVIL (viz NEŽÁDOUCÍ REAKCE a DROGOVÉ INTERAKCE ].
Hypotenze
PRINIVIL může způsobit symptomatickou hypotenzi, někdy komplikovanou oligurií, progresivní azotemií, akutním selháním ledvin nebo smrtí. Mezi pacienty s rizikem nadměrné hypotenze patří pacienti s následujícími stavy nebo charakteristikami: srdeční selhání se systolickým krevním tlakem pod 100 mmHg, ischemická choroba srdeční, cerebrovaskulární onemocnění, hyponatremie, léčba vysokými dávkami diuretik, renální dialýza nebo závažná deplece objemu a/nebo solí jakékoli etiologie.
U těchto pacientů začněte s přípravkem PRINIVIL pod lékařským dohledem a sledujte takové pacienty první dva týdny léčby a vždy, když se dávka PRINIVILu a/nebo diuretika zvýší. Nepoužívejte PRINIVIL 2,5 mg u pacientů, kteří jsou po akutním IM hemodynamicky nestabilní.
Symptomatická hypotenze je možná i u pacientů s těžkou aortální stenózou nebo hypertrofickou kardiomyopatií.
Chirurgie/Anestezie
pacientů podstupujících velkou operaci nebo během anestezie látkami, které vyvolávají hypotenzi, může PRINIVIL blokovat tvorbu angiotenzinu II sekundárně po kompenzačním uvolňování reninu. Pokud se objeví hypotenze a je považována za důsledek tohoto mechanismu, lze ji upravit objemovou expanzí.
Hyperkalémie
U pacientů užívajících PRINIVIL pravidelně monitorujte hladinu draslíku v séru. Léky, které inhibují reninangiotensinový systém, mohou způsobit hyperkalémii. Rizikové faktory pro rozvoj hyperkalémie zahrnují renální insuficienci, diabetes mellitus a současné užívání draslík šetřících diuretik, doplňků draslíku, náhražek soli obsahujících draslík nebo jiných léků, které mohou zvýšit hladinu draslíku v séru [viz DROGOVÉ INTERAKCE ].
Jaterní selhání
ACE inhibitory byly spojovány se syndromem, který začíná cholestatickou žloutenkou nebo hepatitidou a progreduje do fulminantní jaterní nekrózy a někdy i smrti. Mechanismus tohoto syndromu není znám. Pacienti užívající ACE inhibitory, u kterých se rozvine žloutenka nebo výrazné zvýšení jaterních enzymů, by měli ACE inhibitor vysadit a dostat vhodnou léčbu.
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Při podávání lisinoprilu po dobu 105 týdnů samcům a samicím potkanů v dávkách až 90 mg na kg za den nebo po dobu 92 týdnů samcům a samicím myší v dávkách až 135 mg na kg za den nebyl prokázán žádný tumorogenní účinek. Tyto dávky jsou 10krát a 7krát vyšší než MRHDD ve srovnání na základě plochy povrchu těla.
Lisinopril nebyl mutagenní v Amesově mikrobiálním mutagenním testu s metabolickou aktivací nebo bez ní. Byl také negativní v testu přímé mutace s použitím plicních buněk čínského křečka. Lisinopril nevytvářel zlomy jednořetězcové DNA v in vitro alkalickém elučním testu potkaních hepatocytů. Kromě toho lisinopril nezpůsobil zvýšení chromozomálních aberací v in vitro testu na ovariálních buňkách čínského křečka nebo ve studii in vivo na kostní dřeni myší.
U samců a samic potkanů léčených až 300 mg/kg/den lisinoprilu (33násobek MRHDD ve srovnání na základě plochy povrchu těla) nebyly pozorovány žádné nežádoucí účinky na reprodukční schopnost.
Studie na potkanech ukazují, že lisinopril špatně prochází hematoencefalickou bariérou. Vícenásobné dávky lisinoprilu u potkanů nevedou k akumulaci v žádných tkáních. Mléko kojících potkanů obsahuje po podání 14C lisinoprilu radioaktivitu. Celotělovou autoradiografií byla radioaktivita nalezena v placentě po podání značeného léku březím potkanům, ale žádná nebyla nalezena u plodů.
Použití u konkrétních populací
Těhotenství
Shrnutí rizik
PRINIVIL může při podání těhotné ženě způsobit poškození plodu. Užívání léků, které působí na reninangiotensinový systém během druhého a třetího trimestru těhotenství, snižuje funkci ledvin plodu a zvyšuje fetální a neonatální morbiditu a úmrtí. Většina epidemiologických studií zkoumajících abnormality plodu po expozici antihypertenznímu užívání v prvním trimestru nerozlišuje léky ovlivňující reninangiotenzinový systém od jiných antihypertenziv. Při zjištění těhotenství vysaďte přípravek PRINIVIL 5 mg co nejdříve.
Odhadované základní riziko závažných vrozených vad a potratu pro indikovanou populaci není známo. Všechna těhotenství mají na pozadí riziko vrozené vady, ztráty nebo jiných nepříznivých následků. V obecné populaci USA je odhadované základní riziko závažných vrozených vad a potratu u klinicky uznaných těhotenství 2–4 % a 15–20 %.
Klinické úvahy
Mateřské a/nebo embryo/fetální riziko spojené s nemocí
Hypertenze v těhotenství zvyšuje u matky riziko preeklampsie, gestačního diabetu, předčasného porodu a porodních komplikací (např. nutnost císařského řezu a poporodní krvácení). Hypertenze zvyšuje riziko fetálního omezení intrauterinního růstu a intrauterinní smrti. Těhotné ženy s hypertenzí by měly být pečlivě sledovány a odpovídajícím způsobem léčeny.
Fetální/neonatální nežádoucí účinky
Oligohydramnion u těhotných žen, které užívají léky ovlivňující renin-angiotensinový systém ve druhém a třetím trimestru těhotenství, může mít za následek: sníženou funkci ledvin plodu vedoucí k anurii a selhání ledvin, hypoplazii plic plodu a deformaci skeletu, včetně hypoplazie lebky, hypotenzi a smrt. V neobvyklém případě, že u konkrétního pacienta neexistuje vhodná alternativní léčba k lékům ovlivňujícím renin-angiotensinový systém, informujte matku o potenciálním riziku pro plod.
U pacientek užívajících PRINIVIL během těhotenství proveďte sériová ultrazvuková vyšetření k posouzení intraamniotického prostředí. V závislosti na týdnu těhotenství může být vhodné fetální testování. Pokud je pozorován oligohydramnion, vysaďte PRINIVIL 10 mg, pokud to není považováno za život zachraňující pro matku. Pacienti a lékaři by si však měli být vědomi, že oligohydramnion se může objevit až poté, co plod utrpěl nevratné poranění.
Pečlivě sledujte kojence s anamnézou expozice přípravku PRINIVIL in utero kvůli hypotenzi, oligurii a hyperkalémii. U novorozenců s anamnézou expozice PRINIVILU in utero, pokud se objeví oligurie nebo hypotenze, podpořte krevní tlak a renální perfuzi. Výměnné transfuze nebo dialýza mohou být nutné jako prostředek ke zvrácení hypotenze a/nebo náhradě poruchy funkce ledvin.
Laktace
Shrnutí rizik
Nejsou k dispozici žádné údaje týkající se přítomnosti lisinoprilu v mateřském mléce nebo účinků lisinoprilu na kojené dítě nebo na produkci mléka. Lisinopril je přítomen v mléce potkanů. Protože mnoho léků je vylučováno do mateřského mléka a vzhledem k možnosti závažných nežádoucích účinků inhibitorů ACE u kojených dětí, přerušte kojení nebo vysaďte PRINIVIL.
Pediatrické použití
Antihypertenzní účinky a bezpečnost přípravku PRINIVIL byly stanoveny u pediatrických pacientů ve věku 6 až 16 let (viz DÁVKOVÁNÍ A PODÁVÁNÍ a Klinické studie ]. Nebyly zjištěny žádné relevantní rozdíly mezi profilem nežádoucích účinků u pediatrických pacientů a dospělých pacientů.
Bezpečnost a účinnost přípravku PRINIVIL nebyla stanovena u pediatrických pacientů mladších 6 let nebo u pediatrických pacientů s rychlostí glomerulární filtrace KLINICKÁ FARMAKOLOGIE a Klinické studie ].
Geriatrické použití
U starších pacientů není nutná žádná úprava dávkování přípravku PRINIVIL 2,5 mg. V klinické studii přípravku PRINIVIL 10 mg u pacientů s infarktem myokardu (GISSI-3 Trial) bylo 4 413 (47 %) ve věku 65 let a více, zatímco 1 656 (18 %) bylo ve věku 75 a více let. V této studii 4,8 % pacientů ve věku 75 let a starších přerušilo léčbu přípravkem PRINIVIL 5 mg kvůli renální dysfunkci oproti 1,3 % pacientů mladších 75 let. Mezi staršími a mladšími pacienty nebyly pozorovány žádné další rozdíly v bezpečnosti nebo účinnosti, nelze však vyloučit větší citlivost některých starších jedinců.
Závod
ACE inhibitory, včetně PRINIVILu, mají u pacientů černé pleti menší účinek na krevní tlak než u pacientů jiné rasy.
Renální poškození
Úprava dávky přípravku PRINIVIL je nutná u pacientů podstupujících hemodialýzu nebo u pacientů, jejichž clearance kreatininu je ≤ 30 ml/min. U pacientů s clearance kreatininu > 30 ml/min není nutná úprava dávky přípravku PRINIVIL 5 mg (viz DÁVKOVÁNÍ A PODÁVÁNÍ a KLINICKÁ FARMAKOLOGIE ].
PŘEDÁVKOVAT
Po jednorázové perorální dávce 20 g/kg nedošlo u potkanů k žádné letalitě a u jedné z 20 myší, kterým byla podávána stejná dávka, došlo k úmrtí. Nejpravděpodobnějším projevem předávkování by byla hypotenze, jejíž obvyklou léčbou by byla intravenózní infuze normálního fyziologického roztoku.
Lisinopril lze odstranit hemodialýzou [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
KONTRAINDIKACE
PRINIVIL 10 mg je kontraindikován u pacientů s:
- anamnéza angioedému nebo přecitlivělosti související s předchozí léčbou inhibitorem angiotenzin konvertujícího enzymu
- dědičný nebo idiopatický angioedém.
Nepodávejte aliskiren současně s PRINIVILEM 5 mg u pacientů s diabetem [viz DROGOVÉ INTERAKCE ]. PRINIVIL je kontraindikován v kombinaci s inhibitorem neprilysinu (např. sakubitril). Nepodávejte PRINIVIL 2,5 mg do 36 hodin po přechodu na sakubitril/valsartan nebo ze sakubitrilu/valsartanu, přípravku obsahujícího inhibitor neprilysinu (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ a DROGOVÉ INTERAKCE ].
KLINICKÁ FARMAKOLOGIE
Mechanismus působení
Lisinopril inhibuje angiotenzin konvertující enzym (ACE) u lidí a zvířat. ACE je peptidyldipeptidáza, která katalyzuje přeměnu angiotensinu I na vazokonstrikční látku, angiotensin II. Angiotensin II také stimuluje sekreci aldosteronu kůrou nadledvin. Zdá se, že příznivé účinky lisinoprilu u hypertenze a srdečního selhání vyplývají primárně ze suprese systému renin-angiotensinaldosteron. Inhibice ACE vede ke snížení plazmatického angiotensinu II, což vede ke snížení vazopresorické aktivity a ke snížení sekrece aldosteronu. Poslední pokles může vést k malému zvýšení sérového draslíku. U hypertoniků s normální funkcí ledvin léčených samotným PRINIVILEM 10 mg po dobu až 24 týdnů bylo průměrné zvýšení sérového draslíku přibližně 0,1 mEq/l; přibližně 15 % pacientů však mělo zvýšení větší než 0,5 mEq/l a přibližně 6 % mělo pokles větší než 0,5 mEq/l. Ve stejné studii měli pacienti léčení PRINIVILEM 2,5 mg a hydrochlorothiazidem po dobu až 24 týdnů průměrné snížení sérového draslíku o 0,1 mEq/l; přibližně 4 % pacientů mělo zvýšení větší než 0,5 mEq/l a přibližně 12 % mělo pokles větší než 0,5 mEq/l [viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Odstranění negativní zpětné vazby angiotenzinu II na sekreci reninu vede ke zvýšení aktivity plazmatického reninu.
ACE je identický s kininázou, enzymem, který degraduje bradykinin. Zda zvýšené hladiny bradykininu, silného vazodepresorového peptidu, hrají roli v terapeutických účincích přípravku PRINIVIL 5 mg, je třeba ještě objasnit.
Zatímco se předpokládá, že mechanismem, kterým PRINIVIL 2,5 mg snižuje krevní tlak, je primárně suprese systému renin-angiotenzin-aldosteron, PRINIVIL je antihypertenzní i u pacientů s hypertenzí s nízkou hladinou reninu. Ačkoli PRINIVIL 10 mg byl antihypertenzní u všech sledovaných ras, pacienti černé pleti s hypertenzí (obvykle populace s nízkým obsahem reninu) měli menší průměrnou odpověď na monoterapii než pacienti jiné rasy.
Současné podávání přípravku PRINIVIL 5 mg a hydrochlorothiazidu dále snižovalo krevní tlak u černošských a nečerných pacientů a žádný rasový rozdíl v odpovědi krevního tlaku již nebyl patrný.
Farmakodynamika
Hypertenze
Dospělí pacienti
Podávání přípravku PRINIVIL pacientům s hypertenzí vede ke snížení krevního tlaku vleže i vestoje přibližně ve stejném rozsahu bez kompenzační tachykardie. Symptomatická posturální hypotenze obvykle není pozorována, i když se může objevit a měla by být očekávána u pacientů s deplecí objemu a/nebo solí (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ]. Při současném podávání s diuretiky thiazidového typu jsou účinky těchto dvou léků na snížení krevního tlaku přibližně aditivní.
většiny sledovaných pacientů byl nástup antihypertenzní aktivity pozorován za jednu hodinu po perorálním podání jednotlivé dávky PRINIVILU, přičemž maximálního snížení krevního tlaku bylo dosaženo za 6 hodin. Ačkoli byl antihypertenzní účinek pozorován 24 hodin po podání doporučených jednotlivých denních dávek, účinek byl konzistentnější a průměrný účinek byl v některých studiích s dávkami 20 mg nebo vyššími podstatně větší než s nižšími dávkami. Avšak u všech studovaných dávek byl průměrný antihypertenzní účinek podstatně menší 24 hodin po podání než 6 hodin po podání.
Antihypertenzní účinky přípravku PRINIVIL jsou zachovány během dlouhodobé léčby. Náhlé vysazení přípravku PRINIVIL 10 mg nebylo spojeno s rychlým zvýšením krevního tlaku nebo významným zvýšením krevního tlaku ve srovnání s hladinami před léčbou.
Farmakokinetika
Dospělí pacienti
Po perorálním podání PRINIVILu se vrcholové sérové koncentrace lisinoprilu objeví během přibližně 7 hodin, i když u pacientů s akutním infarktem myokardu existovala tendence k malému zpoždění k dosažení maximálních sérových koncentrací. Klesající sérové koncentrace vykazují prodlouženou terminální fázi, která nepřispívá k akumulaci léčiva. Tato terminální fáze pravděpodobně představuje saturovatelnou vazbu na ACE a není úměrná dávce. Při opakovaném podávání lisinoprilu vykazuje účinný poločas 12 hodin.
Nezdá se, že by se lisinopril vázal na jiné sérové proteiny. Lisinopril nepodléhá metabolismu a je zcela vylučován v nezměněné podobě močí. Na základě výtěžku z moči je průměrný rozsah absorpce lisinoprilu přibližně 25 procent, s velkou interindividuální variabilitou (6-60 procent) ve všech testovaných dávkách (5-80 mg). Absorpce lisinoprilu není ovlivněna přítomností potravy v gastrointestinálním traktu. Absolutní biologická dostupnost lisinoprilu je snížena na přibližně 16 procent u pacientů se stabilním městnavým srdečním selháním třídy II-IV NYHA a distribuční objem se zdá být o něco menší než u normálních subjektů.
Biologická dostupnost lisinoprilu po perorálním podání u pacientů s akutním infarktem myokardu je podobná jako u zdravých dobrovolníků.
Porucha funkce ledvin snižuje eliminaci lisinoprilu, který je vylučován převážně ledvinami, ale tento pokles se stává klinicky významným pouze tehdy, když je rychlost glomerulární filtrace nižší než 30 ml/min. Nad touto rychlostí glomerulární filtrace se poločas eliminace jen málo mění. Při větším poškození se však maximální a minimální hladiny lisinoprilu zvyšují, doba do dosažení maximální koncentrace se prodlužuje a doba do dosažení rovnovážného stavu se prodlužuje. Starší pacienti mají v průměru (přibližně zdvojnásobené) vyšší krevní hladiny a plochu pod křivkou plazmatické koncentrace v čase (AUC) než mladší pacienti [viz DÁVKOVÁNÍ A PODÁVÁNÍ ]. Lisinopril lze odstranit hemodialýzou.
Studie na potkanech ukazují, že lisinopril špatně prochází hematoencefalickou bariérou. Vícenásobné dávky lisinoprilu u potkanů nevedou k akumulaci v žádných tkáních. Mléko kojících potkanů obsahuje po podání 14C lisinoprilu radioaktivitu. Celotělovou autoradiografií byla radioaktivita nalezena v placentě po podání značeného léku březím potkanům, ale žádná nebyla nalezena u plodů.
Pediatričtí pacienti
Farmakokinetika lisinoprilu byla studována u 29 pediatrických pacientů s hypertenzí ve věku 6 až 16 let s rychlostí glomerulární filtrace >30 ml/min/1,73 m². Po dávkách 0,1 až 0,2 mg/kg se dosáhly vrcholové plazmatické koncentrace lisinoprilu v ustáleném stavu během 6 hodin a rozsah absorpce na základě výtěžku z moči byl asi 28 %. Tyto hodnoty jsou podobné hodnotám získaným dříve u dospělých. Typická hodnota perorální clearance lisinoprilu (systémová clearance/absolutní biologická dostupnost) u dítěte s hmotností 30 kg je 10 l/h, která se zvyšuje úměrně s funkcí ledvin.
Klinické studie
Hypertenze
Dospělí pacienti
438 pacientů s mírnou až středně těžkou hypertenzí, kteří neužívali diuretika, byly provedeny dvě studie závislosti odpovědi na dávce využívající režim jednou denně. Krevní tlak byl měřen 24 hodin po podání. U některých pacientů byl pozorován antihypertenzní účinek přípravku PRINIVIL při dávce 5 mg. V obou studiích však ke snížení krevního tlaku došlo dříve a bylo větší u pacientů léčených 10, 20 nebo 80 mg PRINIVILU. V kontrolovaných klinických studiích u pacientů s mírnou až středně těžkou hypertenzí byl PRINIVIL 20-80 mg srovnáván s hydrochlorothiazidem 12,5-50 mg as atenololem 50-500 mg a u pacientů se středně těžkou až těžkou hypertenzí s metoprololem 100-200 mg. Byl lepší než hydrochlorothiazid v účincích na systolický a diastolický krevní tlak u populace, která byla ze 75 % bělošská. PRINIVIL 10 mg byl přibližně ekvivalentní atenololu a metoprololu v účincích na diastolický krevní tlak a měl poněkud větší účinky na systolický krevní tlak.
PRINIVIL měl podobnou účinnost a nežádoucí účinky u mladších a starších (>65 let) pacientů. U černochů byl méně účinný než u bělochů.
V hemodynamických studiích přípravku PRINIVIL 5 mg u pacientů s esenciální hypertenzí bylo snížení krevního tlaku doprovázeno snížením periferní arteriální rezistence s malou nebo žádnou změnou srdečního výdeje a srdeční frekvence. Ve studii u devíti pacientů s hypertenzí došlo po podání přípravku PRINIVIL 5 mg ke zvýšení průměrného průtoku krve ledvinami, které nebylo významné. Údaje z několika malých studií jsou nekonzistentní, pokud jde o účinek lisinoprilu na rychlost glomerulární filtrace u hypertoniků s normální funkcí ledvin, ale naznačují, že změny, pokud nějaké jsou, nejsou velké.
U pacientů s renovaskulární hypertenzí se ukázalo, že PRINIVIL je dobře snášen a účinný při snižování krevního tlaku (viz VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ ].
Pediatričtí pacienti
klinické studii zahrnující 115 hypertenzních pediatrických pacientů ve věku 6 až 16 let dostávali pacienti s hmotností 1,25 mg (0,02 mg/kg). Tento účinek byl potvrzen ve fázi vysazení, kdy diastolický tlak vzrostl asi o 9 mmHg více u pacientů randomizovaných na placebo než u pacientů, kteří byli randomizováni k setrvání na středních a vysokých dávkách lisinoprilu. Antihypertenzní účinek lisinoprilu v závislosti na dávce byl konzistentní v několika demografických podskupinách: věk, Tannerovo stadium, pohlaví a rasa. V této studii byl lisinopril obecně dobře snášen.
Ve výše uvedených pediatrických studiích byl lisinopril podáván buď jako tablety nebo v suspenzi těm dětem a kojencům, kteří nebyli schopni polykat tablety nebo kteří vyžadovali nižší dávku, než je dostupná ve formě tablet (viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Srdeční selhání
Ve dvou placebem kontrolovaných 12týdenních klinických studiích bylo srovnáváno přidání přípravku PRINIVIL 2,5 mg až 20 mg denně k digitalisu a samotným diuretikům. Kombinace PRINIVILU, digitalisu a diuretik snížila následující známky a příznaky srdečního selhání: edém, šelest, paroxysmální noční dušnost a roztažení jugulárních žil. V jedné ze studií kombinace PRINIVIL 2,5 mg, digitalis a diuretika snížila ortopnoe, přítomnost třetí srdeční ozvy a počet pacientů klasifikovaných jako NYHA třídy III a IV a zlepšila toleranci zátěže. Velká (přes 3000 pacientů) studie přežití, ATLAS Trial, porovnávající 2,5 a 35 mg lisinoprilu u pacientů se systolickým srdečním selháním, ukázala, že vyšší dávka lisinoprilu měla výsledky přinejmenším stejně příznivé jako nižší dávka. Během výchozích kontrolovaných klinických studií u pacientů užívajících digitalis a diuretika vedly jednotlivé dávky přípravku PRINIVIL 5 mg ke snížení tlaku v zaklínění plicních kapilár, systémové vaskulární rezistenci a krevního tlaku doprovázené zvýšením srdečního výdeje a žádnou změnou srdeční frekvence.
Akutní infarkt myokardu
Studie Gruppo Italiano per lo Studio della Sopravvienza nell'Infarto Miocardico (GISSI-3) byla multicentrická, kontrolovaná, randomizovaná, nezaslepená klinická studie provedená u 19 394 pacientů s akutním infarktem myokardu (IM) přijatých na jednotku koronární péče. Byl navržen tak, aby zkoumal účinky krátkodobé (6 týdnů) léčby lisinoprilem, nitráty, jejich kombinací nebo žádnou léčbou na krátkodobou (6 týdnů) mortalitu a na dlouhodobou smrt a výrazně zhoršenou srdeční funkci. Hemodynamicky stabilní pacienti projevující se do 24 hodin od nástupu příznaků byli randomizováni ve faktoriálním designu 2 x 2 do 6 týdnů buď 1) PRINIVIL samotný (n=4841), 2) samotné nitráty (n=4869), 3 ) PRINIVIL 2,5 mg plus dusičnany (n=4841), nebo 4) otevřená kontrola (n=4843). Všichni pacienti dostávali rutinní terapie, včetně trombolytik (72 %), aspirinu (84 %) a betablokátoru (31 %), podle potřeby, běžně používaných u pacientů s akutním infarktem myokardu (IM).
Protokol vyloučil pacienty s hypotenzí (systolický krevní tlak ≤100 mmHg), těžkým srdečním selháním, kardiogenním šokem a renální dysfunkcí (sérový kreatinin >2 mg/dl a/nebo proteinurie >500 mg za 24 h). Pacienti randomizovaní do skupiny PRINIVIL 5 mg dostávali 5 mg během 24 hodin od nástupu příznaků, 5 mg po 24 hodinách a poté 10 mg denně. Pacienti se systolickým krevním tlakem nižším než 120 mmHg na začátku dostávali 2,5 mg PRINIVILu. Pokud se objevila hypotenze, byla dávka PRINIVIL 10 mg snížena nebo pokud se objevila závažná hypotenze PRINIVIL byl zastaven [viz DÁVKOVÁNÍ A PODÁVÁNÍ ].
Primárními výsledky studie byla celková mortalita po 6 týdnech a kombinovaný cílový ukazatel po 6 měsících po infarktu myokardu, sestávající z počtu pacientů, kteří zemřeli, měli pozdní (4. den) klinické městnavé srdeční selhání nebo měli rozsáhlou levou komoru poškození definované jako ejekční frakce ≤ 35 % nebo akineticko-dyskinetické [AD] skóre ≥ 45 %. Pacienti užívající PRINIVIL (n=9646), samotný nebo s nitráty, měli o 11 % nižší riziko úmrtí (p=0,04) ve srovnání s pacienty, kteří PRINIVIL neužívali (n=9672) (6,4 % vs. 7,2 %, v tomto pořadí) v 6 týdnech. Ačkoli pacienti randomizovaní k podávání PRINIVILu po dobu až 6 týdnů také dosáhli číselně lepšího kombinovaného cílového ukazatele po 6 měsících, otevřená povaha hodnocení srdečního selhání, podstatná ztráta následné echokardiografie a značné nadměrné užívání PRINIVILu 10 mg mezi 6 týdnů a 6 měsíců ve skupině randomizované k 6týdenní léčbě lisinoprilem vylučuje jakýkoli závěr o tomto koncovém bodu.
Pacienti s akutním infarktem myokardu, léčení přípravkem PRINIVIL 10 mg, měli vyšší (9,0 % oproti 3,7 %) výskyt přetrvávající hypotenze (systolický krevní tlak NEŽÁDOUCÍ REAKCE ].
INFORMACE PRO PACIENTA
POZNÁMKA: Tyto informace jsou určeny na pomoc při bezpečném a efektivním používání tohoto léku. Nejedná se o odhalení všech možných nepříznivých nebo zamýšlených účinků.
Těhotenství
Informujte pacientky ve fertilním věku o důsledcích expozice PRINIVILU 10 mg během těhotenství. Diskutujte o možnostech léčby se ženami, které plánují otěhotnět. Řekněte pacientkám, aby co nejdříve hlásily těhotenství svým lékařům.
Angioedém
Angioedém, včetně laryngeálního edému, se může objevit kdykoli během léčby inhibitory angiotenzin konvertujícího enzymu, včetně PRINIVILU. Informujte pacienty, aby okamžitě hlásili jakékoli známky nebo příznaky naznačující angioedém (otoky obličeje, končetin, očí, rtů, jazyka, potíže s polykáním nebo dýcháním) a aby neužívali další lék, dokud se neporadí s předepisujícím lékařem.
Symptomatická hypotenze
Řekněte pacientům, aby hlásili točení hlavy, zejména během prvních několika dnů léčby. Pokud se objeví skutečná synkopa, řekněte pacientovi, aby vysadil lék, dokud se neporadí s předepisujícím lékařem.
Řekněte pacientům, že nadměrné pocení a dehydratace mohou vést k nadměrnému poklesu krevního tlaku v důsledku snížení objemu tekutin. Jiné příčiny objemové deplece, jako je zvracení nebo průjem, mohou také vést k poklesu krevního tlaku; podle toho pacientům poradit.
Hyperkalémie
Řekněte pacientům, aby nepoužívali náhražky soli obsahující draslík bez konzultace s lékařem.
Hypoglykémie
Řekněte diabetickým pacientům léčeným perorálními antidiabetiky nebo inzulinem zahajujícím ACE inhibitor, aby pečlivě sledovali hypoglykémii, zejména během prvního měsíce kombinovaného užívání (viz DROGOVÉ INTERAKCE ].
Leukopenie/Neutropenie
Řekněte pacientům, aby neprodleně hlásili jakýkoli příznak infekce (např. bolest v krku, horečka), která může být známkou leukopenie/neutropenie.
